Генные инженеры научили дрожжи охмелять пиво. Генетическая инженерия дрожжей
Генетическая генная инженерия дрожжи - Справочник химика 21
Создание высокоактивных штаммов с заданными свойствами во многом зависит от уровня знаний об организации генома и регуляции метаболизма микробной клетки. Для Е. соИ известны молекулярные механизмы репликации ДНК, транскрипции и трансляции, регуляции активности разных генов, лучше всего разработаны приемы генетического конструирования in vivo и in vitro. Именно поэтому первые работы по созданию промышленных штаммов микроорганизмов современными методами выполнены на этом микроорганизме. Распространение методологии генной инженерии на другие объекты требует дополнительных исследований. Как уже было показано, здесь достигнуты значительные успехи — сконструированы удобные векторы для псевдомонад, бацилл, актиномицетов и дрожжей. На этой основе будут созданы и уже создаются новые высокоактивные штаммы для промышленности. [c.180]
Конъюгативный перенос бактериальных генов в клетки животных. Перенос генов во время конъюгации бактериальных клеток, когда мужские и женские клетки вступают в контакт друг с другом через объединяющий их цитоплазматический мостик, является широко распространенным и хорошо изученным генетическим явлением [224, 225]. Недавно была продемонстрирована возможность конъюгативного переноса ДНК из бактериальных клеток в культивируемые клетки животных [226]. В этой серии экспериментов В.Л. Ватерсу удалось показать, что гены устойчивости к антибиотикам, находящиеся в составе конъюгатив-ной плазмиды Е. соН, переносятся с низкой частотой в клетки яичников китайских хомячков СНО К1 из бактериальных клеток, давая возможность клеткам-реципиентам выживать на селективной среде в присутствии соответствующих антибиотиков. При этом не происходило поглощения бактериальных клеток клетками животных посредством эндоцитоза, и перенос имел место в присутствии ДНКазы в питательной среде, что исключало непосредственный захват ДНК клетками из культуральной жидкости. Чужеродная ДНК реплицировалась в клетках животных, а экспрессия генов генетических маркеров происходила лишь в том случае, если гены находились под контролем эукариотических промоторов. Хотя конъюгативный перенос генов бактерий в клетки дрожжей, а также растений (Ti-плазмиды) известен давно, обсуждаемая работа впервые продемонстрировала возможность непосредственного обмена генами между бактериями и клетками высших животных. В том случае, если данный процесс удастся оптимизировать, у генной инженерии появится дополнительная возможность введения очень больших молекул ДНК в клетки животных, в том числе и в целях генотерапии. [c.154]
Использование методов генетической инженерии, или рДНК в фитобиотехнологии. Растения — как многоклеточные организмы с огромной емкостью геномов, с половым путем размножения и многоступенчатыми программами развития — являются более сложными объектами для генноинженерных экспериментов, чем, например, вирусы, бактерии и дрожжи. Тем не менее, уже теперь достигнуты определенные успехи с растительными объектами и по прогнозам ученых США к 2000 году ожидается прирост урожайности сельскохозяйственных культур примерно на 60% по сравнению с началом 80-х годов текущего столетия в основном на основе использования методов генетической инженерии, когда стал возможным перенос отдельных генов от одного растения дрзггому (в противоположность естественному половому процессу, при котором происходит замена целых блоков сцепленных генов). [c.510]
Клонирование рекомбинантньк генов и их экспрессия с образованием белковьк продуктов клетками Е. oli и дрожжей, которые можно вырастить в огромных количествах, позволяют осуществить промышленное производство многих полезных белков, которые другими способами получить в больших масштабах очень трудно. Перспективы использования рекомбинантных ДНК привели к возникновению новой ветви молекулярной биологии - генетической инженерии. [c.989]
Большой интерес для генетической инженерии представляет достижение правильной экспрессии клонированной генетической информации в клетках-реципиентах. Экспрессию легко выявить, если клонируемый ген при правильной транскрипции и трансляции обеспечивает функциональную комплементацию мутаций генома клетки. В этом случае нужный гибрид может быть обнаружен простым отбором трансформированных клонов на селективной среде. Например, в одной из первых работ такого типа, выполненной в 1976 г в лаборатории Р. Дэвиса, выяснилось, что гибридная ДНК, полученная при встройке определенных фрагментов хромосомной ДНК дрожжей-сахаромицетов в ДНК векторного фага Я, комплементирует мутацию Е. соН hisB. Клоны, содержащие такие гибриды, отбирали по способности клеток расти на питательной среде без гистидина. В дальнейшем данный подход неоднократно использовался при попытке клонировать чужеродные гены. [c.35]
Рассмотренные примеры демонстрируют, что методы генетической инженерии позволяют создавать новые высокоэффективные технологии с использованием дрожжей-сахаромицетов, направленные на производство различных белков, имеющих важное значение для медицины, ветеринарии и производства продуктов питания. На основе богатого опыта исследований, выполненных на S, erevisiae, активно разрабатываются генно-инженерные системы для других видов дрожжей и грибов, которые представляют интерес для биотехнологических процессов. [c.326]
chem21.info
Генетическая инженерия
ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯспециальности "Химия" и "Биология", 4 курс, 8 семестр
20 часов
д.б.н., профессор С.Н.Щелкунов
Ферменты генетической инженерии, общие принципы конструирования in vitro гибридных молекул ДНК. Понятия о клонирующих, интегративных и экспрессирующих молекулярных векторах. Методы введения молекул ДНК в клетки и отбора гибридных клонов, методы направленного мутагенеза и секвенирования фрагментов ДНК и др. Освещается генно-инженерная система грамотрицательной бактерии Escherichia coli, подходы, реализуемые для достижения повышенной продукции белков, кодируемых клонированными генами. Основные сведения относительно особенностей генно-инженерных систем грамотрицательной бактерии Bacillus subtilis, низшего эукариота дрожжей Saccharomyces cerevisiae и культивируемых клеток тканей животных. Современные подходы к созданию живых поливалентных вакцин, успехи в такой области, как генотерапия. Подчеркивается огромный вклад генетической инженерии в развитие современной биотехнологии. П Р О Г Р А М М Адля биологов и химиков 4 курса ФЕН. Лектор – проф. С.Н. Щелкунов. (32 часа). 1.1. "ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ". Естественно-научный раздел, вузовская компонента
1.2. Дисциплина предназначена для ознакомления студентов с современными представлениями о новейшей области экспериментальной молекулярной биологии – генетической инженерии. Основной целью дисциплины является свободная ориентация студентов в проблематике генетической инженерии бактерий, дрожжей, животных и растений. Для достижения этого выделяются задачи: а). информировать студентов об основных подходах и методических достижениях генетической инженерии; б). дать представления о молекулярных векторах различных систем клонирования генов; в). дать представления о методах создания суперпродуцентов белков в прокариотических и эукариотических системах; в). ознакомить с подходами по созданию современных безопасных противовирусных вакцин методами генетической инженерии; г) дать представление о методах создания трансгенных животных и растений
1.3. По окончании изучения курса студент должен иметь представление о проблематике генетической инженерии и знать основные понятия, методический арсенал и достижения генетической инженерии
1.4. Итоговый контроль: экзамен
2. Содержание дисциплины
2.1. Курс основан на новейших данных о методических возможностях и достижениях генетической инженерии. Аналогичные курсы в России мне не известны
2.2. Тематический план курса
| Наименование разделов и тем | Лекции (часов) | Самостоятельная работа | Всего часов | ||
| Ферменты генетической инженерии | 2 | 1 | 3 | ||
| Общие принципы клонирования генов | 2 | 1 | 3 | ||
| Генно-инженерная система грамотрицательной бактерии E.coli | 6 | 3 | 9 | ||
| 2 | 1 | 3 | |||
| Генно-инженерная система дрожжей S.cerevisiae | 2 | 1 | 3 | ||
| Генетическая инженерия культивируемых клеток животных | 4 | 2 | 6 | ||
| Трансгенные животные и растения | 2 | 1 | 3 | ||
| Итого по курсу | 20 | 10 | 30 |
3.3. Содержание отдельных разделов и тем ВВЕДЕНИЕ. История появления и развития генетической инженерии. ФЕРМЕНТЫ ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИ. Эндонуклеазы рестрикции (рестриктазы). Изменчивость фага l, контролируемая хозяином. Рестрикция-модификация фаговой ДНК в бактериальных клетках. Классификация ферментов рестрикции. Участок узнавания (сайт) рестриктазы на молекуле ДНК. Липкие и тупые концы фрагментов ДНК. Изошизомеры. Прототип. Методы поиска штаммов, продуцирующих рестриктазы.
ДНК-лигазы E.coli и фага Т4. ДНК-полимераза I E.coli, ее ферментативные активности. Фрагмент Кленова ДНК-полимеразы I. Метод репарации, направляемой праймером. Taq полимераза. Полимеразная цепная реакция. Концевая дезоксинуклеотидил трансфераза (терминальная трансфераза). РНК-зависимая ДНК-полимераза (обратная транскриптаза, ревертаза). Нуклеаза Bal31. Полинуклеотидкиназа фага T4. Щелочная фосфатаза. Нуклеаза S1. Экзонуклеаза фага l.
Векторные молекулы ДНК. Требования, предъявляемые к молекулярному вектору. Понятия о клонирующих, интегративных и экспрессирующих векторах.
Введение молекул ДНК в клетки. Компетентность клеток физиологическая и индуцированная. Трансфекция. Трансформация биохимическая (генетическая) и онкогенная. Биохимические и физические методы трансфекции /трансформации.
Методы отбора гибридных клонов. Фенотипическая система селекции. Функциональная комплементация мутаций. Гибридизация нуклеиновых кислот in situ. Радиоиммуноанализ белков in situ.
Методы определения последовательности нуклеотидов (секвенирования) молекул ДНК. ГЕННО-ИНЖЕНЕРНАЯ СИСТЕМА ГРАМОТРИЦАТЕЛЬНОЙ
БАКТЕРИИ ESCHERICHIA COLI Методы введения плазмидных и фаговых молекул ДНК в клетки E.coli. Получение сферопластов. Индукция компетентности клеток. Упаковка фаговой ДНК in vitro. Электропорация. МОЛЕКУЛЯРНЫЕ ВЕКТОРЫ E.COLI. Клонирующие плазмидные векторы. ColE1-, pSC101-, pKN-, pUR-производные. Клонирующие векторы на основе нитевидных фагов. Создание фага M13mp2 и его производных. Преимущества и недостатки векторных нитевидных фагов. Векторы на основе ДНК фага лямбда. Векторы внедрения или замещения. Емкость фаговых векторов. Селекция гибридных фагов. Космиды. Создание библиотек генов. Векторные плазмиды, обеспечивающие прямой отбор гибридных ДНК. Векторы, обеспечивающие экспрессию клонированных нуклеотидных последовательностей в клетках E.coli. Разработка векторов E.coli, детерминирующих секрецию чужеродных белков. ПОДХОДЫ К ДОСТИЖЕНИЮ ПОВЫШЕННОЙ ПРОДУКЦИИ БЕЛКОВ, КОДИРУЕМЫХ КЛОНИРОВАННЫМИ ГЕНАМИ. Эффект дозы гена в экспериментах по молекулярному клонированию. Влияние на уровень экспрессии клонированных генов эффективности их транскрипции. Организация бактериальных промоторов. Сила промотора. Эффективность трансляции матричных РНК. Структура участка связывания рибосом с мРНК. Использование штаммов E.coli с пониженной активностью нуклеаз и протеаз. Оптимизация условий культивирования гибридных штаммов. ЭКСПРЕССИЯ КЛОНИРОВАННЫХ ЭУКАРИОТИЧЕСКИХ ГЕНОВ В КЛЕТКАХ E.COLI. Сравнительный анализ организации генетического аппарата прокариот и эукариот. Экспрессия хромосомных эукариотических генов. Клонирование ДНК-копий матричных РНК и изучение их экспрессии. Клонирование химико-ферментативно синтезированных эукариотических генов. МУТАГЕНЕЗ ГИБРИДНЫХ ДНК. Статистический мутагенез плазмид. Направленный мутагенез молекул ДНК. Сегмент-направленный и сайт-направленный мутагенез. БЕЛКОВАЯ ИНЖЕНЕРИЯ. Получение новых форм белков сайт-направленным мутагенезом. Создание белков с гибридными свойствами. Иммунотоксины. Искусственные иммуногены. Фаговый дисплей. СТАБИЛЬНОСТЬ ВНЕХРОМОСОМНЫХ МОЛЕКУЛ ДНК В КЛЕТКАХ E.COLI Влияние условий культивирования клеток на поддержание плазмид. Структура молекулы ДНК и ее стабильность в клетке. Повторяющиеся последовательности. par-локус. Связь копийности плазмид со стабильностью их наследования. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ ГРАМПОЛОЖИТЕЛЬНОЙ
БАКТЕРИИ BACILLUS SUBTILIS Трансформация клеток бацилл хромосомной ДНК. Плазмидная трансформация компетентных клеток B.subtilis. Введение плазмид в протопласты бацилл. Трансфекция клеток B.subtilis.
Клонирующие векторы B.subtilis на основе плазмид Staphylococcus. Векторная система бацилл на основе плазмид Streptococus. Использование плазмид Bacillus в качестве векторов. Челночные векторные плазмиды, реплицирующиеся как в B.subtilis, так и в E.coli. Плазмидные интегративные векторы. Фаговые векторы бацилл.
Некоторые особенности строения и экспрессии генов бактерий рода Bacillus. Экспрессия в клетках бацилл клонированных генов. Секреция из клеток бацилл чужеродных белков. Стабильность плазмид в клетках B.subtilis. Перспективы использования создаваемых штаммов-продуцентов бацилл в биотехнологии. Бактериальные векторные системы с широким спектром хозяев и задачи, решаемые с их помощью.
ГЕННО-ИНЖЕНЕРНАЯ СИСТЕМА ДРОЖЖЕЙ
SACCHAROMYCES CEREVISIAE Генетическая организация дрожжей-сахаромицетов. Плазмиды дрожжей 2мкм (Scp1) и 3мкм, их молекулярно-генетическая структура. Плазмидная трансформация клеток дрожжей. Получение сферопластов. Индукция компетентности клеток дрожжей.
Векторные молекулы дрожжей-сахаромицетов. Векторы интеграции (YIp-типа). Клонирующие векторы (YEp-, YRp- и YCp-типа). Метод клонирования последовательностей ДНК, обеспечивающих репликацию гибридных плазмид в клетках дрожжей.
Стабильность гибридных молекул ДНК в клетках дрожжей. Метод клонирования центромерных областей дрожжевых хромосом. Клонирование генов в клетках дрожжей. Секреция чужеродных белков из дрожжевых клеток. Генно-инженерные субъединичные вакцины, продуцируемые клетками дрожжей. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ КУЛЬТИВИРУЕМЫХ
КЛЕТОК ЖИВОТНЫХ МЕТОДЫ ПЕРЕНОСА МОЛЕКУЛ ДНК В КЛЕТКИ ЖИВОТНЫХ. Гипертонический солевой метод. ДЭАЭ-декстрановый метод. Кальций-фосфатный метод. Использование липосом для трансфекции вирусных ДНК. Микроинъекция молекул ДНК в клетки животных. Введение плазмид и фрагментов ДНК в культивируемые клетки животных. Прямой перенос плазмид из бактерий в клетки животных. Метод прокалывания клеток. Стабильность гибридных молекул ДНК в клетках животных.
ВЕКТОРНЫЕ СИСТЕМЫ КЛЕТОК ЖИВОТНЫХ. Вирус SV40 как молекулярный вектор. Литические векторы. Использование вирусов помощников. Комплементирующая ранние функции SV40 культура клеток COS. Нелитические эписомные векторы. Трансформирующие векторы. Использование генома вируса полиомы для конструирования молекулярных векторов.
Введение генов в клетки животных совместно с селективным маркером, обусловливающим генетическую (биохимическую) трансформацию клеток. Генетическая трансформация мутантных линий клеток животных. Котрансформация. Доминантные амплифицируемые маркеры генетической трансформации клеток животных. Коамплификация. Эписомные векторы генетической трансформации клеток животных.
Экспрессирующие векторы на основе ортопоксвирусов. Создание живых поливалентных вакцин на основе вируса осповакцины. Типы противовирусных вакцин. ДНК вакцины.
Высокоэффективные экспрессирующие векторы на основе бакуловирусов. ТРАНСГЕННЫЕ ЖИВОТНЫЕ
Методы создания трансгенных животных. Нокаутные животные. Тканеспецифичная и индуцируемая экспрессия трансгенов в организме животных. Подходы к генной терапии и перспективы развития данных исследований.
ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ РАСТЕНИЙ Методы получения трансгенных растений. Бинарная векторная система агробактерий. Прямой перенос трансгенов в растения. Съедобные вакцины. Транспластомные растения. 3.Учебно-методическое обеспечение дисциплины3.3. Образец билета
Билет № 11. Эндонуклеазы рестрикции. Классификация ферментов рестрикции. Изошизомеры. Прототип.
2. Клонирующие векторы на основе нитевидных фагов. Создание фага M13mp2 и его производных. Преимущества и недостатки векторных нитевидных фагов. 3.4. ОСНОВНАЯ ЛИТЕРАТУРА 1. Щелкунов С.Н. Генетическая инженерия: Учеб. пособие: В 2 ч. -
Новосибирск: Изд-во Новосиб. ун-та, 1994; 1997.
2. Уотсон Дж., Туз Дж., Курц Д. Рекомбинантные ДНК. Краткий курс. М.,
Мир", 1986.
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА- Маниатис Т., Фрич Э., Сэмбрук Дж. Молекулярное клонирование. М.,
- Клонирование ДНК. Методы: Пер. с англ./ Под ред. Д.Гловера. - М.:Мир,
- Новое в клонировании ДНК. Методы: Пер. с англ./ Под ред. Д.Гловера. -
Поделитесь с Вашими друзьями:
zodorov.ru
Успехи генной инженерии - опиаты из дрожжей
: 22.08.2015В мировой медицинской практике опиаты были и остаются основными средствами для купирования сильной боли и использования в паллиативной медицине, т.е. для поддержания максимального качества жизни тяжелобольных людей. Это и неудивительно, ведь в организме каждого из нас вырабатываются собственные агонисты опиоидных рецепторов – эндогенные морфины, которые участвуют, в частности, в физиологической системе регуляции боли. Недавно ученые создали генно-инженерный штамм дрожжей, способных производить медицинские опиаты из обычного сахара: первая в цепочке этих биохимических превращений аминокислота тирозин синтезируется из глюкозы в ходе обычных биохимических реакций клетки.
Ежегодно для медицинских и научных задач в мире культивируется около 100 тыс. га опиумного мака Papaver somniferum. Из выращенной биомассы на «выходе» получают более 800 т опиатов, прежде всего, морфина и тебаина. Эти вещества впоследствии в основном химически преобразуют в другие, так называемые полусинтетические, в том числе в оксикодон и гидрокодон (это одно из наиболее часто используемых болеутоляющих, хотя и запрещенное в России).
Но такой «сельскохозяйственный» путь получения опиатов имеет свои недостатки: например, соотношение алкалоидов в маковом сырье может варьировать в зависимости от условий внешней среды. Однако производство опиатов путем химического синтеза сложно и коммерчески неконкурентоспособно по сравнению с этим традиционным способом. Наконец, недавно был создан генетически модифицированный штамм дрожжей, способный производить опиаты.
Как известно, генетически модифицированные организмы имеют искусственно измененную ДНК: современные технологии генной инженерии позволяют переносить отдельные гены из одного организма в другой. Перенесенный ген встраивается в геном организма-реципиента, который в результате получает новый признак (например, устойчивость к насекомым-вредителям). Генетически модифицированные организмы могут использоваться и как биореакторы для наработки химических веществ или фармакологических соединений - рекомбинантных белков. Так, методом рекомбинантной технологии с использованием в качестве продуцента кишечной палочки Escherihia coli сегодня получают генно-инженерный человеческий инсулин.
Иногда сконструировать такой биореактор удается легко, однако все гораздо сложнее в ситуации, когда требуется не просто «подсадить» организму-реципиенту один ген, но воссоздать сложную цепочку биохимических превращений. Именно это и произошло в случае с опиатами: ученым никак не «поддавалась» стадия превращения тирозина в леводопу (3-гидрокси-L-тирозин) - предшественник дофамина. Поиск решения вели несколько научных коллективов, но успех сопутствовал ученым из Стэнфордского университета (США). Чтобы вся сложная биохимическая цепочка заработала, всего в геном дрожжей пришлось внести более двух десятков генов от разных организмов (бактерий, растений и млекопитающего - крысы). В итоге удалось заставить дрожжи производить гидрокодон и тебаин (вещество-предшественник для многих опиатов).
Имеются опасения, что биотехнологическая технология позволит «варить» опиаты «на кухне», однако ученые утверждают, что этот процесс слишком сложен и неэффективен с точки зрения наркобизнеса, поэтому никакой реальной угрозы не существует. С другой стороны, эта работа, во-первых, еще раз подчеркивает высокий потенциал дрожжевых клеток как биореактора для производства «проблемных» молекул. Во-вторых, она может стать основой для разработки и синтеза обезболивающих лекарств на основе опиатов, имеющих меньшее количество побочных эффектов, включая наркозависимость, чем природные алкалоиды.
По: http://news.sciencemag.org и http://www.nature.com
Подготовила Мария Перепечаева
: 22.08.2015scfh.ru
Дрожжи с генами хмеля - vechnayamolodost.ru
Генные инженеры научили дрожжи охмелять пиво
Дарья Спасская, N+1
Биоинженеры создали генетически модифицированные дрожжи, которые синтезируют ароматические компоненты хмеля – терпеновые спирты гераниол и линалоол. В процессе приготовления пива с этими дрожжами хмель можно не добавлять, что значительно удешевляет и упрощает процесс производства. Двойное слепое тестирование экспериментальной партии напитка показало, что такое пиво обладает даже более выраженным вкусом и ароматом, чем американский эль, приготовленный традиционным способом. Научная статья с описанием разработки дрожжевых штаммов и их тестирования опубликована в Nature Communications.
Хмель придает пиву характерную горечь и аромат. Чтобы добиться нужного вкуса, хмель добавляют в сусло в процессе варки, а для придания аромата – на более поздних стадиях приготовления напитка; эту процедуру называют охмелением пива. Существует множество сортов хмеля, которые отличаются концентрацией ароматических компонентов. Однако даже в пределах одного сорта возможен разброс в содержании эфирных масел, и это одна из причин, почему характеристики пива бывает сложно стандартизировать.
Ароматическая фракция хмеля содержит множество компонентов, однако исследователи установили, что основной вклад в охмеление пива, по крайней мере, для сортов, популярных среди американских пивоваров, вносят две молекулы из класса терпенов – гераниол и линалоол. Эти вещества образуются из одного предшественника с участием двух разных ферментов-синтаз.
Биоинженеры из университета Калифорнии и института биоэнергетики в Эмеривилле (США) в сотрудничестве с калифорнийской пивоваренной компанией Lagunitas разработали технологию, позволяющую охмелять пиво без использования хмеля. Для этого в геном промышленного штамма дрожжей, используемого в пивоварении, встроили гены ферментов синтеза гераниола и линалоола. Кроме того, исследователи научились регулировать экспрессию этих генов, чтобы направленно изменять вкусовые качества пива.
Так как ферменты, участвующие в синтезе этих терпенов, непосредственно в хмеле до сих пор не идентифицированы, ученые проверили несколько генов синтаз линалоола и гераниола из других ароматных растений. Оказалось, что достаточный уровень активности в клетках дрожжей для двух этих веществ проявляет укороченная версия фермента из мяты и полноразмерный фермент из базилика. Для того, чтобы обеспечить синтез предшественника терпенов, биоинженерам пришлось также сверхэкспрессировать несколько собственных ферментов дрожжей. Для интеграции генетических кассет в ДНК дрожжей исследователи использовали систему CRISPR-Cas9.
Чтобы протестировать новую технологию на деле, авторы работы приготовили с каждым из штаммов небольшую опытную партию пива без использования хмеля. Для приготовления контрольных «традиционных» партий использовали хмель сорта Каскад с пяти разных американских ферм. Сравнение пива показало, что использование хмеля из разных мест приводит к разбросу в концентрациях терпенов, и, следовательно, к вариациям вкуса напитка. В то же время использование модифицированных дрожжей давало более стабильный результат.
В финальном эксперименте исследователи приготовили американский эль по классическому рецепту с использованием технологии «сухого охмеления», когда хмель добавляют в пиво уже на стадии брожения, либо с генетически модифицированными дрожжами. Дегустаторы в двойном слепом тестировании не заметили значимой разницы между наличием или отсутствием «сухого охмеления», однако опытное пиво, приготовленное с модифицированными дрожжами, явно отличалось хмельным ароматом.
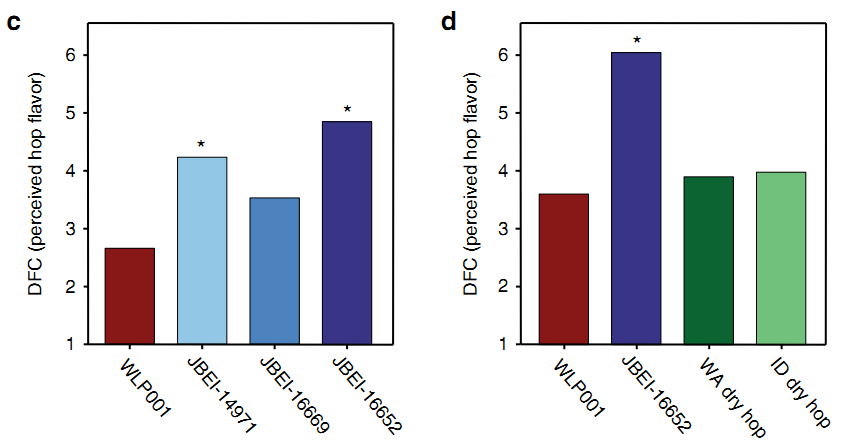
Слева: сравнение выраженности «хмелевой компоненты» пива, приготовленного с использованием родительского штамма WLP001 или с тремя его генно-модифицированными производными (JBEI). Справа: сравнение пива, приготовленного с технологией сухого охмеления (ID dry hop) или без нее (WA dry hop) с пивом, приготовленным с использованием модифицированного штамма JBEI. Звездочка обозначает статистически значимое различие. Charles M. Denby et al / Nature Communications, 2018.
Исследователи признают, что наиболее полный вкусовой букет напитка может достигаться за счет других ароматических компонентов хмеля. Тем не менее, предложенная технология генной модификации дрожжей позволяет добавлять нужные пути синтеза в промышленные штаммы, и таким образом, дополнять вкус пива.
Портал «Вечная молодость» http://vechnayamolodost.ru
www.vechnayamolodost.ru
Генетическая инженерия
ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯспециальности "Химия" и "Биология", 4 курс, 8 семестр
20 часов
д.б.н., профессор С.Н.Щелкунов
Ферменты генетической инженерии, общие принципы конструирования in vitro гибридных молекул ДНК. Понятия о клонирующих, интегративных и экспрессирующих молекулярных векторах. Методы введения молекул ДНК в клетки и отбора гибридных клонов, методы направленного мутагенеза и секвенирования фрагментов ДНК и др. Освещается генно-инженерная система грамотрицательной бактерии Escherichia coli, подходы, реализуемые для достижения повышенной продукции белков, кодируемых клонированными генами. Основные сведения относительно особенностей генно-инженерных систем грамотрицательной бактерии Bacillus subtilis, низшего эукариота дрожжей Saccharomyces cerevisiae и культивируемых клеток тканей животных. Современные подходы к созданию живых поливалентных вакцин, успехи в такой области, как генотерапия. Подчеркивается огромный вклад генетической инженерии в развитие современной биотехнологии. П Р О Г Р А М М Аспецкурса "ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ"
для биологов и химиков 4 курса ФЕН. Лектор – проф. С.Н. Щелкунов. (32 часа). 1.1. "ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ". Естественно-научный раздел, вузовская компонента
1.2. Дисциплина предназначена для ознакомления студентов с современными представлениями о новейшей области экспериментальной молекулярной биологии – генетической инженерии. Основной целью дисциплины является свободная ориентация студентов в проблематике генетической инженерии бактерий, дрожжей, животных и растений. Для достижения этого выделяются задачи: а). информировать студентов об основных подходах и методических достижениях генетической инженерии; б). дать представления о молекулярных векторах различных систем клонирования генов; в). дать представления о методах создания суперпродуцентов белков в прокариотических и эукариотических системах; в). ознакомить с подходами по созданию современных безопасных противовирусных вакцин методами генетической инженерии; г) дать представление о методах создания трансгенных животных и растений
1.3. По окончании изучения курса студент должен иметь представление о проблематике генетической инженерии и знать основные понятия, методический арсенал и достижения генетической инженерии
1.4. Итоговый контроль: экзамен
2. Содержание дисциплины
2.1. Курс основан на новейших данных о методических возможностях и достижениях генетической инженерии. Аналогичные курсы в России мне не известны
2.2. Тематический план курса
| Наименование разделов и тем | Лекции (часов) | Самостоятельная работа | Всего часов | ||
| Ферменты генетической инженерии | 2 | 1 | 3 | ||
| Общие принципы клонирования генов | 2 | 1 | 3 | ||
| Генно-инженерная система грамотрицательной бактерии E.coli | 6 | 3 | 9 | ||
| Генетическая инженерия грамположительной бактерии B.subtilis | 2 | 1 | 3 | ||
| Генно-инженерная система дрожжей S.cerevisiae | 2 | 1 | 3 | ||
| Генетическая инженерия культивируемых клеток животных | 4 | 2 | 6 | ||
| Трансгенные животные и растения | 2 | 1 | 3 | ||
| Итого по курсу | 20 | 10 | 30 |
3.3. Содержание отдельных разделов и тем ВВЕДЕНИЕ. История появления и развития генетической инженерии. ФЕРМЕНТЫ ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИ. Эндонуклеазы рестрикции (рестриктазы). Изменчивость фага l, контролируемая хозяином. Рестрикция-модификация фаговой ДНК в бактериальных клетках. Классификация ферментов рестрикции. Участок узнавания (сайт) рестриктазы на молекуле ДНК. Липкие и тупые концы фрагментов ДНК. Изошизомеры. Прототип. Методы поиска штаммов, продуцирующих рестриктазы.
ДНК-лигазы E.coli и фага Т4. ДНК-полимераза I E.coli, ее ферментативные активности. Фрагмент Кленова ДНК-полимеразы I. Метод репарации, направляемой праймером. Taq полимераза. Полимеразная цепная реакция. Концевая дезоксинуклеотидил трансфераза (терминальная трансфераза). РНК-зависимая ДНК-полимераза (обратная транскриптаза, ревертаза). Нуклеаза Bal31. Полинуклеотидкиназа фага T4. Щелочная фосфатаза. Нуклеаза S1. Экзонуклеаза фага l.
ОБЩИЕ ПРИНЦИПЫ КЛОНИРОВАНИЯ ГЕНОВ Методы конструирования гибридных молекул ДНК. Коннекторный и рестриктазно-лигазный методы. Линкерные молекулы и их использование.Векторные молекулы ДНК. Требования, предъявляемые к молекулярному вектору. Понятия о клонирующих, интегративных и экспрессирующих векторах.
Введение молекул ДНК в клетки. Компетентность клеток физиологическая и индуцированная. Трансфекция. Трансформация биохимическая (генетическая) и онкогенная. Биохимические и физические методы трансфекции /трансформации.
Методы отбора гибридных клонов. Фенотипическая система селекции. Функциональная комплементация мутаций. Гибридизация нуклеиновых кислот in situ. Радиоиммуноанализ белков in situ.
Методы определения последовательности нуклеотидов (секвенирования) молекул ДНК. ГЕННО-ИНЖЕНЕРНАЯ СИСТЕМА ГРАМОТРИЦАТЕЛЬНОЙ
БАКТЕРИИ ESCHERICHIA COLI Методы введения плазмидных и фаговых молекул ДНК в клетки E.coli. Получение сферопластов. Индукция компетентности клеток. Упаковка фаговой ДНК in vitro. Электропорация. МОЛЕКУЛЯРНЫЕ ВЕКТОРЫ E.COLI. Клонирующие плазмидные векторы. ColE1-, pSC101-, pKN-, pUR-производные. Клонирующие векторы на основе нитевидных фагов. Создание фага M13mp2 и его производных. Преимущества и недостатки векторных нитевидных фагов. Векторы на основе ДНК фага лямбда. Векторы внедрения или замещения. Емкость фаговых векторов. Селекция гибридных фагов. Космиды. Создание библиотек генов. Векторные плазмиды, обеспечивающие прямой отбор гибридных ДНК. Векторы, обеспечивающие экспрессию клонированных нуклеотидных последовательностей в клетках E.coli. Разработка векторов E.coli, детерминирующих секрецию чужеродных белков. ПОДХОДЫ К ДОСТИЖЕНИЮ ПОВЫШЕННОЙ ПРОДУКЦИИ БЕЛКОВ, КОДИРУЕМЫХ КЛОНИРОВАННЫМИ ГЕНАМИ. Эффект дозы гена в экспериментах по молекулярному клонированию. Влияние на уровень экспрессии клонированных генов эффективности их транскрипции. Организация бактериальных промоторов. Сила промотора. Эффективность трансляции матричных РНК. Структура участка связывания рибосом с мРНК. Использование штаммов E.coli с пониженной активностью нуклеаз и протеаз. Оптимизация условий культивирования гибридных штаммов. ЭКСПРЕССИЯ КЛОНИРОВАННЫХ ЭУКАРИОТИЧЕСКИХ ГЕНОВ В КЛЕТКАХ E.COLI. Сравнительный анализ организации генетического аппарата прокариот и эукариот. Экспрессия хромосомных эукариотических генов. Клонирование ДНК-копий матричных РНК и изучение их экспрессии. Клонирование химико-ферментативно синтезированных эукариотических генов. МУТАГЕНЕЗ ГИБРИДНЫХ ДНК. Статистический мутагенез плазмид. Направленный мутагенез молекул ДНК. Сегмент-направленный и сайт-направленный мутагенез. БЕЛКОВАЯ ИНЖЕНЕРИЯ. Получение новых форм белков сайт-направленным мутагенезом. Создание белков с гибридными свойствами. Иммунотоксины. Искусственные иммуногены. Фаговый дисплей. СТАБИЛЬНОСТЬ ВНЕХРОМОСОМНЫХ МОЛЕКУЛ ДНК В КЛЕТКАХ E.COLI Влияние условий культивирования клеток на поддержание плазмид. Структура молекулы ДНК и ее стабильность в клетке. Повторяющиеся последовательности. par-локус. Связь копийности плазмид со стабильностью их наследования. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ ГРАМПОЛОЖИТЕЛЬНОЙ
БАКТЕРИИ BACILLUS SUBTILIS Трансформация клеток бацилл хромосомной ДНК. Плазмидная трансформация компетентных клеток B.subtilis. Введение плазмид в протопласты бацилл. Трансфекция клеток B.subtilis.
Клонирующие векторы B.subtilis на основе плазмид Staphylococcus. Векторная система бацилл на основе плазмид Streptococus. Использование плазмид Bacillus в качестве векторов. Челночные векторные плазмиды, реплицирующиеся как в B.subtilis, так и в E.coli. Плазмидные интегративные векторы. Фаговые векторы бацилл.
Некоторые особенности строения и экспрессии генов бактерий рода Bacillus. Экспрессия в клетках бацилл клонированных генов. Секреция из клеток бацилл чужеродных белков. Стабильность плазмид в клетках B.subtilis. Перспективы использования создаваемых штаммов-продуцентов бацилл в биотехнологии. Бактериальные векторные системы с широким спектром хозяев и задачи, решаемые с их помощью.
ГЕННО-ИНЖЕНЕРНАЯ СИСТЕМА ДРОЖЖЕЙ
SACCHAROMYCES CEREVISIAE Генетическая организация дрожжей-сахаромицетов. Плазмиды дрожжей 2мкм (Scp1) и 3мкм, их молекулярно-генетическая структура. Плазмидная трансформация клеток дрожжей. Получение сферопластов. Индукция компетентности клеток дрожжей.
Векторные молекулы дрожжей-сахаромицетов. Векторы интеграции (YIp-типа). Клонирующие векторы (YEp-, YRp- и YCp-типа). Метод клонирования последовательностей ДНК, обеспечивающих репликацию гибридных плазмид в клетках дрожжей.
Стабильность гибридных молекул ДНК в клетках дрожжей. Метод клонирования центромерных областей дрожжевых хромосом. Клонирование генов в клетках дрожжей. Секреция чужеродных белков из дрожжевых клеток. Генно-инженерные субъединичные вакцины, продуцируемые клетками дрожжей. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ КУЛЬТИВИРУЕМЫХ
КЛЕТОК ЖИВОТНЫХ МЕТОДЫ ПЕРЕНОСА МОЛЕКУЛ ДНК В КЛЕТКИ ЖИВОТНЫХ. Гипертонический солевой метод. ДЭАЭ-декстрановый метод. Кальций-фосфатный метод. Использование липосом для трансфекции вирусных ДНК. Микроинъекция молекул ДНК в клетки животных. Введение плазмид и фрагментов ДНК в культивируемые клетки животных. Прямой перенос плазмид из бактерий в клетки животных. Метод прокалывания клеток. Стабильность гибридных молекул ДНК в клетках животных.
ВЕКТОРНЫЕ СИСТЕМЫ КЛЕТОК ЖИВОТНЫХ. Вирус SV40 как молекулярный вектор. Литические векторы. Использование вирусов помощников. Комплементирующая ранние функции SV40 культура клеток COS. Нелитические эписомные векторы. Трансформирующие векторы. Использование генома вируса полиомы для конструирования молекулярных векторов.
Введение генов в клетки животных совместно с селективным маркером, обусловливающим генетическую (биохимическую) трансформацию клеток. Генетическая трансформация мутантных линий клеток животных. Котрансформация. Доминантные амплифицируемые маркеры генетической трансформации клеток животных. Коамплификация. Эписомные векторы генетической трансформации клеток животных.
Экспрессирующие векторы на основе ортопоксвирусов. Создание живых поливалентных вакцин на основе вируса осповакцины. Типы противовирусных вакцин. ДНК вакцины.
Высокоэффективные экспрессирующие векторы на основе бакуловирусов. ТРАНСГЕННЫЕ ЖИВОТНЫЕ
Методы создания трансгенных животных. Нокаутные животные. Тканеспецифичная и индуцируемая экспрессия трансгенов в организме животных. Подходы к генной терапии и перспективы развития данных исследований.
ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ РАСТЕНИЙ Методы получения трансгенных растений. Бинарная векторная система агробактерий. Прямой перенос трансгенов в растения. Съедобные вакцины. Транспластомные растения. 3.Учебно-методическое обеспечение дисциплины3.3. Образец билета
Билет № 11. Эндонуклеазы рестрикции. Классификация ферментов рестрикции. Изошизомеры. Прототип.
2. Клонирующие векторы на основе нитевидных фагов. Создание фага M13mp2 и его производных. Преимущества и недостатки векторных нитевидных фагов. 3.4. ОСНОВНАЯ ЛИТЕРАТУРА 1. Щелкунов С.Н. Генетическая инженерия: Учеб. пособие: В 2 ч. -
Новосибирск: Изд-во Новосиб. ун-та, 1994; 1997.
2. Уотсон Дж., Туз Дж., Курц Д. Рекомбинантные ДНК. Краткий курс. М.,
Мир", 1986.
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА- Маниатис Т., Фрич Э., Сэмбрук Дж. Молекулярное клонирование. М.,
- Клонирование ДНК. Методы: Пер. с англ./ Под ред. Д.Гловера. - М.:Мир,
- Новое в клонировании ДНК. Методы: Пер. с англ./ Под ред. Д.Гловера. -
Поделитесь с Вашими друзьями:
bio.ekonoom.ru
Генные инженеры научили дрожжи охмелять пиво
Дрожжи Saccharomyces cerevisiae под электронным микроскопом
Wikimedia Commons
Биоинженеры создали генетически модифицированные дрожжи, которые синтезируют ароматические компоненты хмеля – терпеновые спирты гераниол и линалоол. В процессе приготовления пива с этими дрожжами хмель можно не добавлять, что значительно удешевляет и упрощает процесс производства. Двойное слепое тестирование экспериментальной партии напитка показало, что такое пиво обладает даже более выраженным вкусом и ароматом, чем американский эль, приготовленный традиционным способом. Научная статья с описанием разработки дрожжевых штаммов и их тестирования опубликована в Nature Communications.
Хмель придает пиву характерную горечь и аромат. Чтобы добиться нужного вкуса, хмель добавляют в сусло в процессе варки, а для придания аромата – на более поздних стадиях приготовления напитка; эту процедуру называют охмелением пива. Существует множество сортов хмеля, которые отличаются концентрацией ароматических компонентов. Однако даже в пределах одного сорта возможен разброс в содержании эфирных масел, и это одна из причин, почему характеристики пива бывает сложно стандартизировать.
Ароматическая фракция хмеля содержит множество компонентов, однако исследователи установили, что основной вклад в охмеление пива, по крайней мере, для сортов, популярных среди американских пивоваров, вносят две молекулы из класса терпенов – гераниол и линалоол. Эти вещества образуются из одного предшественника с участием двух разных ферментов-синтаз.
Биоинженеры из университета Калифорнии и института биоэнергетики в Эмеривилле (США) в сотрудничестве с калифорнийской пивоваренной компанией Lagunitas разработали технологию, позволяющую охмелять пиво без использования хмеля. Для этого в геном промышленного штамма дрожжей, используемого в пивоварении, встроили гены ферментов синтеза гераниола и линалоола. Кроме того, исследователи научились регулировать экспрессию этих генов, чтобы направленно изменять вкусовые качества пива.
Так как ферменты, участвующие в синтезе этих терпенов, непосредственно в хмеле до сих пор не идентифицированы, ученые проверили несколько генов синтаз линалоола и гераниола из других ароматных растений. Оказалось, что достаточный уровень активности в клетках дрожжей для двух этих веществ проявляет укороченная версия фермента из мяты и полноразмерный фермент из базилика. Для того, чтобы обеспечить синтез предшественника терпенов, биоинженерам пришлось также сверхэкспрессировать несколько собственных ферментов дрожжей. Для интеграции генетических кассет в ДНК дрожжей исследователи использовали систему CRISPR-Cas9.
Чтобы протестировать новую технологию на деле, авторы работы приготовили с каждым из штаммов небольшую опытную партию пива без использования хмеля. Для приготовления контрольных «традиционных» партий использовали хмель сорта Каскад с пяти разных американских ферм. Сравнение пива показало, что использование хмеля из разных мест приводит к разбросу в концентрациях терпенов, и, следовательно, к вариациям вкуса напитка. В то же время использование модифицированных дрожжей давало более стабильный результат.
В финальном эксперименте исследователи приготовили американский эль по классическому рецепту с использованием технологии «сухого охмеления», когда хмель добавляют в пиво уже на стадии брожения, либо с генетически модифицированными дрожжами. Дегустаторы в двойном слепом тестировании не заметили значимой разницы между наличием или отсутствием «сухого охмеления», однако опытное пиво, приготовленное с модифицированными дрожжами, явно отличалось хмельным ароматом.
Слева: сравнение выраженности "хмелевой компоненты" пива, приготовленного с использованием родительского штамма WLP001 или с тремя его генно-модифицированными производными (JBEI). Справа: сравнение пива, приготовленного с технологией сухого охмеления (ID dry hop) или без нее (WA dry hop) с пивом, приготовленным с использованием модифицированного штамма JBEI. Звездочка обозначает статистически значимое различие.
Charles M. Denby et al / Nature Communications 2018
Исследователи признают, что наиболее полный вкусовой букет напитка может достигаться за счет других ароматических компонентов хмеля. Тем не менее, предложенная технология генной модификации дрожжей позволяет добавлять нужные пути синтеза в промышленные штаммы, и таким образом, дополнять вкус пива.Впрочем, ученые показали, что вкус пива может субъективно улучшить даже подходящая музыка, сопровождающая процесс распития напитка.
Дарья Спасская
nplus1.ru
Учебно-методический комплекс «Генетическая инженерия»
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИФГАОУ ВО «НОВОСИБИРСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
Факультет естественных наук| УТВЕРЖДАЮ | |
| Декан ФЕН НГУ, профессор | |
| _____________ Резников В.А. | |
| «____»______________ 2015 г. |
Учебно-методический комплекс
«Генетическая инженерия»4 курс, VIII семестр
Новосибирск
2015 г. Рабочая программа курса лекций ориентирована на студентов 4 курса факультета естественных наук, направление подготовки 020400 "Биология" (бакалавр). В состав разработки включены: программа курса лекций, структура курса, приведены примеры контрольных вопросов по материалам лекций на экзамене.
Составитель
Щелкунов Сергей Николаевич
© Новосибирский государственный университет, 2015
Содержание:
Аннотация рабочей программы 4
1. Цели освоения дисциплины 5
2. Место дисциплины в структуре ООП 5
3. Компетенции обучающегося, формируемые в результате освоения дисциплины «Генетическая инженерия»
4. Структура и содержание дисциплины 7
Рабочий план 8
5. Образовательные технологии. 18
6. Учебно-методическое обеспечение самостоятельной работы студентов. Оценочные средства для текущего контроля успеваемости, промежуточной аттестации по итогам освоения дисциплины. 18
Образцы вопросов для подготовки к экзамену.
7. Учебно-методическое и информационное обеспечение дисциплины 20
8. Материально-техническое обеспечение дисциплины 21 Аннотация рабочей программы
Дисциплина «Генетическая инженерия» является частью биологического цикла ООП по направлению подготовки «020400 БИОЛОГИЯ» (квалификация (степень) бакалавр). в области, касающейся вариативной части профессионального цикла. Дисциплина реализуется на Факультете естественных наук Федерального государственного бюджетного образовательного учреждения высшего профессионального образования Новосибирского государственного университета (НГУ) кафедрой молекулярной биологии.
Содержание дисциплины охватывает основы современных представлений о сформировавшихся и развивающихся направлениях в области разработки векторных систем для клонирования и экспрессии генов в клетках бактерий, дрожжей, млекопитающих и растений с целью создания организмов со свойствами, важными для практического применения в биотехнологии, медицине и сельском хозяйстве.
Дисциплина предназначена для повышения биологической грамотности и развития абстрактного и структурного стиля мышления у студентов-биологов и нацелена на формирование у выпускника общекультурных компетенций: ОК-3, OK-4, профессиональных компетенций: ПК-4 ПК-6, ПК-11.
Преподавание дисциплины предусматривает следующие формы организации учебного процесса: лекции, самостоятельная работа студента.
Результатом прохождения дисциплины является итоговая оценка по пятибалльной шкале (экзамен).
Программой дисциплины предусмотрены следующие виды контроля:
Текущий контроль. Формой текущего контроля при прохождении дисциплины «Генетическая инженерия» является контроль посещаемости занятий. и сдача домашних заданий.
Для того чтобы быть допущенным к экзамену, студент должен в ходе обучения посетить не менее 70 % лекционных занятий и сдать два домашних задания.
Итоговый контроль. Итоговую оценку за семестр студент может получить на экзамене в конце семестра в виде любой положительной или неудовлетворительной оценки.
Общая трудоемкость дисциплины составляет 2 зачетных единицы, 72 академических часа. Программой дисциплины предусмотрены 30 часов лекционных, 2 часа на прием экзаменов, 4 часа на сдачу домашних заданий, а также 36 часов самостоятельной работы студентов, которая включает подготовку домашних заданий и к экзамену.
1. Цели освоения дисциплины
Основной целью освоения дисциплины "Генетическая инженерия" является приобретение студентами знаний по современным направлениям этой новейшей области экспериментальной молекулярной биологии. Для достижения поставленной цели выделяются задачи представить в курсе лекций информацию о современных направлениях создания молекулярных векторов различных систем клонирования генов, методах получения суперпродуцентов белков в прокариотических и эукариотических системах, подходам по созданию современных безопасных противовирусных вакцин методами генетической инженерии, методам создания трансгенных животных и растений.
2. Место дисциплины в структуре ООПДисциплина «Генетическая инженерия» является частью биологического цикла ООП, вариативная (профильная) часть профессионального цикла, по направлению подготовки «020400 БИОЛОГИЯ», уровень подготовки – «бакалавр».
Дисциплина «Генетическая инженерия» опирается на следующие дисциплины данной ООП:
- Микробиология.
- Ботаника (про- и эукариоты, высшие организмы).
- Молекулярная биология (структура и функции белков и нуклеиновых кислот, гены и геномы, самоорганизация живых систем, биотехнология).
- Биохимия.
- Генетика.
- Иммунология.
Результаты освоения дисциплины «Генетическая инженерия» используются в следующих дисциплинах данной ООП:
- Механизмы репликации, транскрипции и трансляции;
- Молекулярная вирусология;
- Мутагенез и репарация;
- Эпигенетические механизмы регуляции экспрессии генов.
3. Компетенции обучающегося, формируемые в результате освоения дисциплины «Генетическая инженерия» Общекультурные компетенции
- ОК-3: способен к адаптации и повышению своего научного и культурного уровня;
- ОК-4 выстраивает и реализует перспективные линии интеллектуального, культурного, нравственного, физического и профессионального саморазвития и самосовершенствования.
Общепрофессиональные
- ПК-4: демонстрирует знание истории и методологии биологических наук, расширяющие общепрофессиональную, фундаментальную подготовку;
- ПК-6: творчески применяет современные компьютерные технологии при сборе, хранении, обработке, анализе и передаче биологической информации;
- ПК-11: демонстрирует современные представления об основах биотехнологии и генной инженерии, нанобиотехнологии, молекулярного моделирования.
В результате освоения дисциплины обучающийся должен:
- иметь представление о современных и развивающихся направлениях генетической инженерии;
- знать биохимические и молекулярно-биологические основы генетической инженерии;
- знать об особенностях методов, используемых для получения новых векторных систем и суперпродуцентов целевых белков;
- иметь представление о перспективах развития генетической инженерии и связанных с ней областей наук о жизни.
Формы контроля.
Текущий контроль. Формой текущего контроля при прохождении дисциплины «Генетическая инженерия» является контроль посещаемости занятий.
Итоговый контроль. Для контроля усвоения дисциплины учебным планом предусматривается экзамен.
4. Структура и содержание дисциплины Общая трудоемкость дисциплины составляет 2 зачетных единицы, 72 академических часа.
| № п/п | Раздел дисциплины | Семестр | Неделя семестра | Виды учебной работы, включая самостоятельную работу студентов и трудоемкость (в часах) | Формы текущего контроля успеваемости (по неделям семестра) Форма промежуточной аттестации (по семестрам) | ||||||
| Лекции | Самост. работа | Экзамен+домашние задания | |||||||||
| 1 | Ферменты генетической инженерии. | 8 | 1 | 2 | - | - | 2 | ||||
| 2 | Общие принципы клонирования генов. | 8 | 2,3 | 4 | - | - | 2 | ||||
| 3 | Генно-инженерная система грамотрицательной бактерии E. coli. | 8 | 4, 5, 6, 7 | 8 | - | - | 8 | Сдача домашнего задания | |||
| 4 | Генетическая инженерия грамположительной бактерии B. subtilis. | 8 | 8,9 | 4 | - | - | 2 | ||||
| 5 | Генно-инженерная система дрожжей S. cerevisiae. | 8 | 10,11 | 4 | - | - | 2 | ||||
| 6 | Генетическая инженерия культивируемых клеток животных. | 8 | 12,13 | 4 | - | - | 6 | ||||
| 7 | Трансгенные животные и растения. | 8 | 14,15 | 4 | - | - | 2 | Сдача домашнего задания | |||
| 8 | Подготовка к экзамену | 8 | 12 | 2 | Экзамен | ||||||
| Итого | 30 | 36 | 2 | ||||||||
Рабочий план. Тема 1. ФЕРМЕНТЫ ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИ.
Эндонуклеазы рестрикции (рестриктазы). Изменчивость фага , контролируемая хозяином. Рестрикция-модификация фаговой ДНК в бактериальных клетках. Классификация ферментов рестрикции. Участок узнавания (сайт) эндонуклеазы рестрикции на молекуле ДНК. Липкие и тупые концы фрагментов ДНК, генерируемые эндонуклеазами рестрикции. Изошизомеры. Методы поиска штаммов, продуцирующих эндонуклеазы рестрикции.
ДНК-лигазы E.coli и фага Т4. ДНК-полимераза I E.coli, ее ферментативные активности. Фрагмент Кленова ДНК-полимеразы I. Метод репарации, направляемой праймером. Taq полимераза. Полимеразная цепная реакция. Концевая дезоксинуклеотидил трансфераза (терминальная трансфераза). РНК-зависимая ДНК-полимераза (обратная транскриптаза, ревертаза). Нуклеаза Bal31. Тема 2. ОБЩИЕ ПРИНЦИПЫ КЛОНИРОВАНИЯ ГЕНОВ
Методы конструирования гибридных (рекомбинантных) молекул ДНК (рекДНК). Коннекторный и рестриктазно-лигазный методы. Линкерные молекулы и их использование при конструировании рекДНК. Применение полимеразной цепной реакции в извлечении и клонировании фрагментов ДНК.
Векторные молекулы ДНК. Требования, предъявляемые к молекулярному вектору. Понятия о клонирующих, интегративных и экспрессирующих молекулярных векторах.
Введение молекул ДНК в клетки. Компетентность клеток физиологическая и индуцированная. Трансфекция. Трансформация генетическая. Биохимические и физические методы трансфекции /трансформации.
Методы отбора гибридных клонов бактериальных клеток. Фенотипическая система селекции. Функциональная комплементация мутаций. Гибридизация нуклеиновых кислот in situ. Радиоиммуноанализ белков in situ.
Тема 3. ГЕННО-ИНЖЕНЕРНАЯ СИСТЕМА ГРАМОТРИЦАТЕЛЬНОЙ БАКТЕРИИ Escherichia coli
Методы введения плазмидных и фаговых молекул ДНК в клетки E.coli. Получение сферопластов. Индукция компетентности клеток. Упаковка ДНК фага лямбда in vitro. Электропорация.
МОЛЕКУЛЯРНЫЕ ВЕКТОРЫ E. coli.
Клонирующие плазмидные векторы. ColE1-, pSC101-, pUR-производные.
Клонирующие векторы на основе ДНК нитевидных фагов. Создание фага M13mp2 и его производных. Преимущества и недостатки векторных нитевидных фагов.
Векторы на основе ДНК фага лямбда. Векторы внедрения или замещения. Емкость фаговых векторов. Селекция гибридных фагов.
Космиды. Создание библиотек и энциклопедий генов.
Векторные плазмиды, обеспечивающие прямой отбор гибридных ДНК. Векторы, обеспечивающие экспрессию клонированных нуклеотидных последовательностей в клетках E. coli. Разработка векторов E. coli, детерминирующих секрецию чужеродных белков.
ПОДХОДЫ К ДОСТИЖЕНИЮ ПОВЫШЕННОЙ ПРОДУКЦИИ БЕЛКОВ, КОДИРУЕМЫХ КЛОНИРОВАННЫМИ ГЕНАМИ. Эффект дозы гена в экспериментах по молекулярному клонированию. Влияние на уровень экспрессии клонированных генов эффективности их транскрипции. Организация бактериальных промоторов. Сила промотора. Эффективность трансляции матричных РНК. Частота встречаемости кодонов в составе матричных РНК. Структура участка связывания рибосом с мРНК. Использование штаммов E. coli с пониженной активностью нуклеаз и протеаз. Оптимизация условий культивирования гибридных штаммов. Тельца включения.
ЭКСПРЕССИЯ КЛОНИРОВАННЫХ ЭУКАРИОТИЧЕСКИХ ГЕНОВ В КЛЕТКАХ E. coli. Сравнительный анализ организации генетического аппарата прокариот и эукариот. Возможность экспрессии хромосомных эукариотических генов в бактериальных клетках. Клонирование ДНК-копий матричных РНК и изучение их экспрессии. Клонирование химико-ферментативно синтезированных эукариотических генов. Создание белков с гибридными свойствами. Иммунотоксины. Искусственные иммуногены. Фаговый дисплей.
СТАБИЛЬНОСТЬ ВНЕХРОМОСОМНЫХ МОЛЕКУЛ ДНК В КЛЕТКАХ E.coli. Влияние условий культивирования клеток на поддержание плазмид. Структура молекулы ДНК и ее стабильность в клетке. Повторяющиеся последовательности. par-локус. Связь копийности плазмид со стабильностью их наследования. Тема 4. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ ГРАМПОЛОЖИТЕЛЬНОЙ БАКТЕРИИ Bacillus subtilis
Трансформация клеток бацилл хромосомной ДНК. Плазмидная трансформация компетентных клеток B. subtilis. Введение плазмид в протопласты бацилл.
Клонирующие векторы B. subtilis на основе плазмид Staphylococcus. Механизм репликации плазмид Staphylococcus. Челночные векторные плазмиды, реплицирующиеся как в B. subtilis, так и в E. coli.
Некоторые особенности строения и экспрессии генов бактерий рода Bacillus по сравнению с генами E. coli. Экспрессия в клетках бацилл клонированных генов. Секреция из клеток бацилл чужеродных белков. Молекулярные векторы экспрессии-секреции клеток бацилл. Стабильность плазмид в клетках B. subtilis. Перспективы использования создаваемых штаммов-продуцентов бацилл в биотехнологии.
Тема 5. ГЕННО-ИНЖЕНЕРНАЯ СИСТЕМА ДРОЖЖЕЙ Saccharomyces cerevisiaeГенетическая организация дрожжей-сахаромицетов. Плазмиды дрожжей 2мкм (Scp1) и 3мкм, их молекулярно-генетическая структура. Плазмидная трансформация клеток дрожжей. Получение сферопластов. Индукция компетентности клеток дрожжей.
Векторные молекулы дрожжей-сахаромицетов. Векторы интеграции (YIp-типа). Клонирующие векторы (YEp-, YRp- и YCp-типа), их сравнительные характеристики. Метод клонирования последовательностей ДНК, обеспечивающих репликацию гибридных плазмид в клетках дрожжей.
Стабильность гибридных молекул ДНК в клетках дрожжей. Метод клонирования центромерных областей дрожжевых хромосом. Клонирование генов в клетках дрожжей. Секреция чужеродных белков из дрожжевых клеток. Генно-инженерные субъединичные вакцины, продуцируемые клетками дрожжей.
Тема 6. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ КУЛЬТИВИРУЕМЫХ КЛЕТОК МЛЕКОПИТАЮЩИХМЕТОДЫ ПЕРЕНОСА МОЛЕКУЛ ДНК В КЛЕТКИ ЖИВОТНЫХ. Гипертонический солевой метод. ДЭАЭ-декстрановый метод. Кальций-фосфатный метод. Использование липосом для трансфекции вирусных ДНК. Микроинъекция молекул ДНК в клетки животных. Введение плазмид и фрагментов ДНК в культивируемые клетки животных. Прямой перенос плазмид из бактерий в клетки животных. Метод прокалывания клеток.
ВЕКТОРНЫЕ СИСТЕМЫ КЛЕТОК ЖИВОТНЫХ. Вирус SV40 как молекулярный вектор. Литические векторы. Использование вирусов-помощников. Комплементирующая ранние функции SV40 культура клеток COS. Нелитические эписомные молекулярные векторы на основе генетических элементов SV40.
Введение генов в клетки животных совместно с селективным маркером, обусловливающим генетическую трансформацию клеток. Генетическая трансформация мутантных линий клеток животных. Котрансформация. Доминантные амплифицируемые маркеры генетической трансформации клеток животных. Коамплификация. Эписомные векторы генетической трансформации клеток животных.
Аденовирусы в качестве молекулярных векторов. Комплементирующая линия клеток 293. Выпотрошенный молекулярный вектор на основе аденовируса. Генная терапия.
Экспрессирующие векторы на основе ортопоксвирусов. Временная доминантная селекция и ее использование для направленного введения в поксвирусный геном целевых генов и/или делеций. Создание живых поливалентных вакцин на основе вируса осповакцины. Типы противовирусных вакцин. ДНК вакцины.
Высокоэффективные экспрессирующие векторы на основе бакуловирусов. Клонирующая система Bac-to-Bac. Тема 7. ТРАНСГЕННЫЕ ЖИВОТНЫЕ И РАСТЕНИЯ
Методы создания трансгенных животных. Нокаутные животные. Тканеспецифичная и индуцируемая экспрессия трансгенов в организме животных. Подходы к генной терапии и перспективы развития данных исследований.
Методы получения трансгенных растений. Бинарная векторная система агробактерий. Прямой перенос трансгенов в растения. Съедобные вакцины. Транспластомные растения. 5. Образовательные технологии. Виды/формы образовательных технологий.
Преподавание курса ведется в виде лекций. Каждую лекцию сопровождает подготовленная и постоянно обновляющаяся презентация.
Преподаватель курса является действующим специалистом в области микробиологии и генетической инженерии и заинтересован в освоении студентами основ генетической инженерии. В связи с этим со студентами на лекциях часто обсуждаются задачи, построенные на основе современных исследовательских данных. 6. Учебно-методическое обеспечение самостоятельной работы студентов. Оценочные средства для текущего контроля успеваемости, промежуточной аттестации по итогам освоения дисциплины.
Формой текущего контроля при прохождении дисциплины «Генетическая инженерия» является контроль посещаемости занятий.
Для того, чтобы быть допущенным к экзамену, студент должен выполнить следующее: в ходе прохождения дисциплины посетить не менее 70 % занятий.
Учебно-методическое обеспечение дисциплины: при подготовке к лекциям студенты могут использовать рекомендованные преподавателем литературные источники и Интернет-ресурсы, а также любую доступную справочную литературу, программное обеспечение и базы данных. Образцы вопросов для подготовки к экзамену
- Изменчивость фага , контролируемая хозяином. Рестрикция-модификация фаговой ДНК в бактериальных клетках.
- Эндонуклеазы рестрикции (рестриктазы). Классификация ферментов рестрикции.
- Участок узнавания (сайт) рестриктазы на молекуле ДНК. Липкие и тупые концы фрагментов ДНК, генерируемые эндонуклеазами рестрикции 2-го класса. Изошизомеры.
- Методы поиска штаммов, продуцирующих эндонуклеазы рестрикции 2-го класса.
- ДНК-полимераза I E.coli, ее ферментативные активности. Фрагмент Кленова ДНК-полимеразы I.
- Полимеразная цепная реакция.
- Методы конструирования гибридных (рекомбинантных) молекул ДНК. Коннекторный и рестриктазно-лигазный методы.
- Линкерные молекулы и их использование при клонировании фрагментов ДНК. Применение полимеразной цепной реакции в извлечении и клонировании фрагментов ДНК.
- Векторные молекулы ДНК. Требования, предъявляемые к молекулярному вектору. Понятия о клонирующих, интегративных и экспрессирующих векторах.
- Введение молекул ДНК в клетки бактерий. Компетентность клеток физиологическая и индуцированная. Трансфекция. Трансформация генетическая.
- Методы отбора гибридных клонов бактериальных клеток.
- Методы введения плазмидных и фаговых молекул ДНК в клетки E. coli.
- Клонирующие плазмидные векторы. pSC101-, ColE1-производные.
- Клонирующие векторы на основе нитевидных фагов.
- Векторы на основе ДНК фага лямбда.
- Космиды. Создание библиотек и энциклопедий генов.
- Векторные плазмиды, обеспечивающие прямой отбор гибридных ДНК.
- Векторы, обеспечивающие экспрессию клонированных нуклеотидных последовательностей в клетках E. coli.
- Эффект дозы гена в экспериментах по молекулярному клонированию. Влияние на уровень экспрессии клонированных генов эффективности их транскрипции.
- Использование штаммов E. coli с пониженной активностью нуклеаз и протеаз для суперпродукции белков.
- Клонирование ДНК-копий матричных РНК и изучение их экспрессии.
- Клонирование химико-ферментативно синтезированных эукариотических генов.
- Иммунотоксины. Искусственные иммуногены.
- Фаговый дисплей и области его применения.
- Влияние структуры молекулы ДНК на ее стабильность в бактериальной клетке.
- Клонирующие векторы B. subtilis на основе плазмид Staphylococcus.
- Особенности строения и экспрессии генов бактерий рода Bacillus по сравнению с генами E. coli.
- Молекулярные векторы экспрессии-секреции из клеток бацилл чужеродных белков.
- Плазмиды дрожжей 2мкм (Scp1) и 3мкм, их молекулярно-генетическая структура.
- Плазмидная трансформация клеток дрожжей.
- Векторные молекулы дрожжей-сахаромицетов. Векторы интеграции (YIp-типа).
- Клонирующие векторы дрожжей (YEp-, YRp- и YCp-типа).
- Стабильность гибридных молекул ДНК в клетках дрожжей.
- Генно-инженерные субъединичные вакцины, продуцируемые клетками дрожжей.
- Введение плазмид и фрагментов ДНК в культивируемые клетки млекопитающих.
- Вирус SV40 как молекулярный вектор.
- Генетическая трансформация мутантных линий клеток животных.
- Котрансформация клеток млекопитающих. Доминантные амплифицируемые маркеры генетической трансформации клеток животных.
- Аденовирусы в качестве молекулярных векторов. Выпотрошенный вектор.
- Экспрессирующие векторы на основе ортопоксвирусов. Создание живых поливалентных вакцин на основе вируса осповакцины.
- Высокоэффективные экспрессирующие векторы на основе бакуловирусов.
- Методы создания трансгенных животных.
- Подходы к генной терапии и перспективы развития данных исследований.
- Бинарная векторная система агробактерий для получения трансгенных растений. Прямой перенос трансгенов в растения.
- Транспластомные растения.
- Съедобные вакцины.
7. Учебно-методическое и информационное обеспечение дисциплины При подготовке к лекциям, экзамену и выполнении домашних заданий студенты могут использовать рекомендованные преподавателем литературные источники и Интернет-ресурсы, а также любую доступную справочную литературу, программное обеспечение и базы данных.
Список основной литературы:
- Щелкунов С.Н. Генетическая инженерия: Учеб.-справ. пособие. – 4-е изд., испр. и доп. – Новосибирск: Сиб. унив. изд-во, 2010. – 514 с.
Список дополнительной литературы:
- Патрушев Л. И. Искусственные генетические системы. Т. 1. Генная и белковая инженерия. – М.: Наука, 2004. – 526 с.
- Уотсон Дж., Туз Дж., Курц Д. Рекомбинантные ДНК. Краткий курс. М., «Мир», 1986. - 285 с.
8. Материально-техническое обеспечение дисциплины.
- Ноутбук, медиа-проектор, экран.
- Программное обеспечение для демонстрации слайд-презентаций.
Программа составлена в соответствии с требованиями ФГОС ВПО по направлению «020400 Биология», а также в соответствии с Образовательным стандартом высшего профессионального образования, принятым в Федеральном государственном бюджетном образовательном учреждении высшего профессионального образования «Новосибирский национальный исследовательский государственный университет».
Автор: Щелкунов Сергей Николаевич, д.б.н., профессор кафедры молекулярной биологии НГУ, заведующий отделом геномных исследований и разработки методов ДНК-диагностики поксвирусов ФБУН ГНЦ вирусологии и биотехнологии «Вектор». Программа одобрена на заседании кафедры молекулярной биологии ФЕН"23" января 2015 г. Секретарь кафедры к.х.н., доцент _____________ Л. М. Халимская.
www.dereksiz.org
 |  |  |  |  |  |  |  |  |  |  |  |  |  |  |
 Пример видео 3 Пример видео 3 |  Пример видео 2 Пример видео 2 |  Пример видео 6 Пример видео 6 |  Пример видео 1 Пример видео 1 |  Пример видео 5 Пример видео 5 |  Пример видео 4 Пример видео 4 |
Администрация муниципального образования «Городское поселение – г.Осташков»
























