2. Производство серной кислоты. Серная кислота хлеб химической промышленности
Серная кислота
Наименование: Серная кислота (Sulfuric acid)Формула: h3SO4
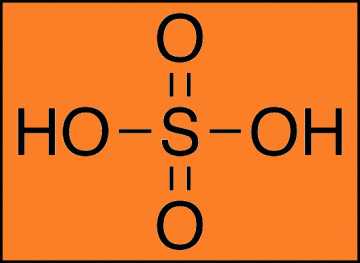
Внешний вид: жидкость без цвета и запаха, имеющая маслянистую консистенцию
 Химические свойства: молярная масса – 98,1 г/моль. Плотность составляет 1,8 г/см³. Температура плавления- 10,3 °C. Является хорошим окислителем.
Химические свойства: молярная масса – 98,1 г/моль. Плотность составляет 1,8 г/см³. Температура плавления- 10,3 °C. Является хорошим окислителем.
Спецификация
| Показатель | Значение показателя |
| Содержание основного вещества, % | ≥98 |
| Массовая доля золы, % | ≤0.02 |
| Массовая доля железа, % | ≤0.005 |
| Массовая доля мышьяка, % | ≤0.0001 |
| Массовая доля ртути, % | ≤0.001 |
| Массовая доля свинца, % | ≤0.005 |
| Прозрачность (мм) | ≥80 |
| Стандарт | GB/T534-2002 |
Упаковка: в бочках и канистрах различного объёма
Условия хранения: хранить в закрытом складском помещении отдельно от других веществ. Место должно быть хорошо проветриваемом и исключать проникновение солнечных лучей, а также других источников тепла. Предпочтителен цементный пол, либо отсутствие материалов, которые могли бы вступить в химическую реакцию с кислотой. Большие склады должны быть окружены ограждениями для сбора кислоты в случае утечки и снабжены средствами нейтрализации. Вне помещения для хранения кислот должны располагаться пожарный гидрант и автономное дыхательное оборудование на случай чрезвычайной ситуации и необходимости проведения спасательных работ. Утечки должны быть немедленно ликвидированы путем промывания струей воды; в случае большой утечки персонал должен покинуть помещение, а затем нейтрализовать кислоту. Имеющееся оборудование должно быть водонепроницаемым и стойким к воздействию кислот. Цилиндрические контейнеры должны храниться на стеллажах и быть закреплены. Баллоны с газообразными ангидридами должны храниться в вертикальном положении и иметь колпаки. Пустые и полные емкости предпочтительно хранить раздельно.
Дополнительная информация:
История: серная кислота известна миру приблизительно с 10 века н.э. Только тогда она имела название "купоросное масло", это объясняется методом получения данного вещества (прокаливание купоросов). Шло время, расширялись сферы применения серной кислоты, а объёмы ее производства стояли на месте, тогда и возникла потребность в поиске нового способа получения этого вещества. В 15 веке было обнаружено, что серную кислоту можно получить путём сжигания серы и селитры. В 17 веке серная кислота, получаемая новым способом, стала выпускаться в производственных масштабах, так как был осуществлен переход производства с использованием лабораторных колб к производству с использованием свинцовых ящиков и камер. В 19 веке был предложен третий способ изготовления кислоты: из пирита (FeS2). Нередко серную кислоту называют хлебом химической промышленности, стоит только взглянуть на области ее использования, и становится ясно - такое название дано ей по праву.
himoptovik.ru
2. Производство серной кислоты
Серную кислоту не случайно называют "хлебом" химической промышленности. Она используется в производстве других кислот, химических волокон, цветных металлов, при мойке шерсти. В основном кислоту применяют в выпуске фосфорных удобрений. Многоплановое ее применение обусловлено сильной химической активностью, дешевизной производства, удобствами использования - не дымит, не выделяет запаха, а в концентрированном виде не разрушает черные металлы.
Сырьем для производства серной кислоты могут быть различные серосодержащие вещества, но наибольшее практическое значение имеют колчедан, элементарная сера, сернистые газы цветной металлургии, сжигания угля, очистки нефти. Колчедан получают в основном как побочный продукт флотационного обогащения. Он имеет низкую себестоимость, хорошую транспортабельность, что делает его основным сырьем в сернокислотном производстве. Основу флотационного колчедана составляет пирит (FeS2), содержащий до 45% железа и серу. В нем имеются также сульфиды мышьяка, селена и др., которые образуют газообразные соединения, попадают в сернистые газы и ухудшают их качество. Поэтому сернистые газы требуют дополнительной очистки, что усложняет технологическую схему производства. Достаточно распространенное сырье - элементарная сера. Она наиболее концентрированный серосодержащий ресурс. В результате более эффективны дальние перевозки, снижается расход сырья на выпуск единицы продукции более чем в 2 раза по сравнению с колчеданом. Процесс производства кислоты проще, требует меньших удельных капвложений, экологичнее. Чистая сера имеет достаточную тепловую способность (10000 кдж/кг), что позволяет при получении сернистого газа использовать ее не только как сырье для кислоты, но и как источник энергии в теплоэнергоблоках для собственных производственных целей и поставки другим потребителям (рис.1).Однако запасы элементарной серы в природе ограничены, а
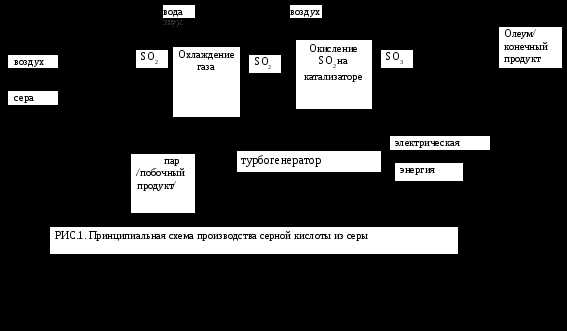
Сжигание серы
абсорбция SO3 и образование серной кислоты
Серная кислота
себестоимость ее добычи высокая. Это обусловливает повышенную стоимость конечного продукта по сравнению с кислотой, полученной из колчедана. Наиболее эффективное сырье для выпуска кислоты - сернистые газы цветной металлургии, очистки нефти, сероводород природного газа. Себестоимость тонны кислоты из них в 2,5 - 6 раз меньше, чем из элементарной серы и колчедана, сам процесс достаточно экологичен, а в окружающую среду в результате утилизации серы не попадают вредные соединения. Техногенные выбросы серы в атмосферу вдвое превышают ее мировую добычу в качестве сырья для промышленности.
Значительные запасы серы в сульфатах - гипсе, ангидриде. Однако эти виды сырья менее эффективны из-за больших энергетических затрат в производстве.
Исходным этапом производства серной кислоты является получение сернистого ангидрида (SO2). Для этого колчедан дробят, обжигают в многоподовых печаx, в кипящем слое, как и в металлургическом процессе. При этом газы составляют основной продукт, а оксиды железа - побочный. Образуется так называемый огарок - твердые отходы, содержащие окислы железа, как и в богатых железных рудах, а также незначительную часть невыгоревшей серы (до 2%) и минеральные примеси. Каждый кубический метр сернистых газов содержит до 300 г пыли, а также мышьяк, селен, теллур, фтор и другие вещества, которые загрязняют кислоту, снижают активность катализатора. Поэтому газы обжига колчедана очищают (рис. 2). При использовании высококачественного сырья с практическим отсутствием примесей - элементарной серы, сероводорода - сжигание проводится через форсунки в более простых печах. В этом случае не образуется огарок, а сернистые газы без предварительной очистки применяются в выпуске кислоты, что упрощает технологический процесс, повышает его экологичность (рис.1,3). В производстве кислоты из газов цветной металлургии отсутствует стадия обжига, а сернистые газы в производстве используются после предварительной очистки. Это уменьшает удельные капитальные вложения при создании сернокислотных предприятий.
Основная сложность сернокислотного производства - получение из сернистого ангидрида серного (S03), так как взаимодействие сернистых газов с кислородом в обычных условиях осуществляется медленно и для промышленных процессов не приемлемо. В зависимости от метода ускорения отмеченной химической реакции существуют способы получения кислоты: контактный и нитрозный. При нитрозном способе в качестве ускорителя реакции применяют двуокись азота, которая отдает кислород сернистым газам и превращается в окись азота. Последняя вновь окисляется кислородом воздуха до двуокиси и взаимодействует с сернистыми газами. Серный ангидрид соединяется с водой и образует 75% кислоту, которую упаривают до товарного продукта, содержащего 98,5% кислоты. Этот процесс проводят в специальных металлических
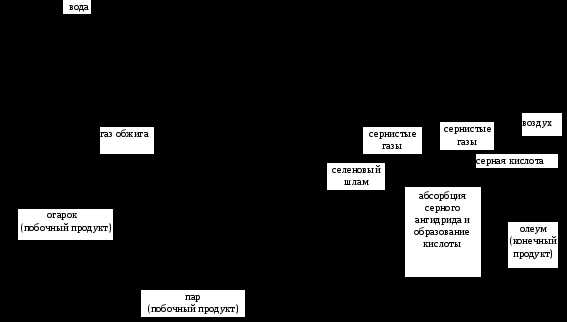
Обжиг колчедана
Охлаждение газа
Очистка газа от пыли
Промывка и сушка газа
подогрев газа
Окисление сернистого ангидрида в серный на катализаторе
колчедан
воздух
сернистый ангидрид
РИС. 2. Принципиальная схема производства серной кислоты
башнях, футерованных кислотоустойчивым кирпичом. Поэтому нитрозный способ называют еще башенным.
Контактный способ основан на окислении сернистых газов воздухом, кислородом в присутствии ванадиевого катализатора в контактных аппаратах. Серный ангидрид направляют в абсорбционные башни, куда подается концентрированная серная кислота. Она поглощает серные газы и образуется 100% серная кислота, в которой избыточно растворим ангидрид (Н2S04 • nSО3). Этот продукт называют олеумом. Рассмотренный способ прогрессивнее по сравнению с нитрозным. При контактном получении кислоты - скорость окисления выше, особенно при использовании кислорода, что повышает единичную производительность оборудования, лучше качество конечного продукта, а производство - экологичнее (меньше выбросов окислов азота). В технологическом процессе практически не расходуют топливо. Поэтому подавляющую часть серной кислоты вырабатывают контактным методом.
Размещение сернистого производства обусловлено особенностями сырьевых ресурсов и имеет в зависимости от этого ориентацию на сырье или центры потребления. При использовании сернистых газов промышленности предприятия ориентированы на центры переработки нефти, цветной металлургии как комбинированные производства на основе утилизации отходов и имеют сырьевую ориентацию (Новополоцк). Здесь могут создаваться также предприятия-потребители серной кислоты, выпускающие фосфорные удобрения (Ревда - Россия, Алаверди - Армения и др.). Получение кислоты из колчедана, элементарной серы имеет территориальную ориентацию на пункты потребления как нематериалоемкое производство (Гомель). На 1 т 100% серной кислоты расходуют около 800 кг колчедана или 350 кг элементарной серы, 0,1 кг контактной массы, 100 кВт•ч электрической энергии и 50 куб.м воды. Такое влияние потребителя на размещение предприятий усиливается также худшей транспортабельностью готовой продукции по сравнению с сырьем. Перевозка кислоты требует специальных транспортных средств, упаковки, соблюдения более сложных условий безопасности.
studfiles.net
Серная кислота | Рефераты KM.RU
Серная кислота
Химическое производство представляет собой сложную химико-технологическую систему (ХТС), сложность которой определяется как наличием большого количества связей, элементов и подсистем, так и разнообразием решаемых задач. Основной целью химического производства является получение химического (целевого) продукта заданного качества при минимальных затратах и возможно меньшим количестве отходов. Для анализа ХТС и возможности их оптимизации необходима модель процесса, отражающая, в первую очередь, связи между элементами и их взаимное влияние друг на друга. Основой такой модели служит баланс масс в системе.
Расчет материального баланса является основным этапом в проектной работе инженеров химиков-технологов. На основе материальных балансов определяется целый ряд важнейших техно-экономических показателей и характеристик основных аппаратов. Из данных материальных балансов определяют: расход сырья и вспомогательных материалов для обеспечения заданной производительности; тепловой баланс и, соответственно, расход энергии и теплообменную аппаратуру; экономический баланс производства, себестоимость продукции и, следовательно, рентабельность производства. Материальный баланс позволяет оценить степень совершенства производства (комплексность использования сырья, номенклатуру и количество отходов), а также проанализировать причины потерь. При расчете баланса задаются величиной механических потерь, которая, как правило, не должна превышать 5%. Эти потери определяются не столько несовершенством технологии или дефектами оборудования, сколько культурой производства в целом.
Технология серной кислоты.
Среди минеральных кислот, производимых химической промышленностью, серная кислота по объему производства и потребления занимает первое место. Объясняется это и тем, что она самая дешевая из всех кислот, а также ее свойствами. Серная кислота не дымит, в концентрированном виде не разрушает черные металлы, в то же время является одной из самых сильных кислот, в широком диапазоне температур (от –40…-20 до 260-336,5 ºС) находится в жидком состоянии.
Области применения серной кислоты чрезвычайно обширны. Существенная ее часть используется как полупродукт в различных отраслях химической промышленности, прежде всего для получения минеральных удобрений, а также солей, кислот, взрывчатых веществ. Серная кислота применяется и при производстве красителей, химических волокон, в металлургической, текстильной, пищевой промышленности и т. д.
Серная кислота может существовать как самостоятельное химическое соединение h3SO4, а также в виде соединений с водой
h3SO4*2h3O, h3SO4*h3O, h3SO4 *4h3O и с триоксидом серы h3SO4 *SO3 , h3SO4*2SO3.
В технике серной кислотой называют и безводную h3SO4 и ее водные растворы (по сути дела, это смесь h3O, h3SO4 и соединений h3SO4*nh3O), и растворы триоксида серы в безводной h3SO4 – олеум (смесь h3SO4 и соединений h3SO4*nSO3)
Безводная серная кислота – тяжелая маслянистая бесцветная жидкость, смешивающаяся с водой и триоксидом серы в любом соотношении. Физические свойства серной кислоты, такие, как плотность, температура кристаллизации, температура кипения, зависят от ее состава.
Безводная 100%-ная серная кислота имеет сравнительно высокую температуру кристаллизации 10,7ºC. Чтобы уменьшить возможность замерзания товарного продукта при перевозке и хранении, концентрацию технической серной кислоты выбирают такой, чтобы она имела достаточно низкую температуру кристаллизации. Промышленность выпускает три вида товарной серной кислоты (башенная кислота, контактная кислота и олеум).
Рассмотренные свойства серной кислоты необходимо учитывать как при выборе технологического режима процесса, так и при проектировании отдельных аппаратов, трубопроводов и т. д. Например, при размещении цеха на открытой площадке необходимо предусмотреть теплоизоляцию трубопроводов, по которым циркулируют растворы серной кислоты, имеющие достаточно высокие температуры кристаллизации. Учет диаграммы фазового равновесия паров и жидкости позволяет правильно выбрать условия проведения стадии абсорбции триоксида серы, обеспечивающие высокую степень абсорбции и предупреждающие побочные явления, такие, например, как образование сернокислотного тумана.
Сырье для серной кислоты и методы ее получения.
Исходными реагентами для получения серной кислоты могут быть элементная сера и серосодержащие соединения, из которых можно получить либо серу, либо диоксид серы
Традиционно основными источниками сырья являются сера и железный (серный) колчедан. Около половины серной кислоты получают из серы, треть – из колчедана. Значительное место в сырьевом балансе занимают отходящие газы цветной металлургии, содержащие диоксид серы.
В то же время отходящие газы – наиболее дешевое сырье, низки оптовые цены и на колчедан, наиболее же дорогостоящим сырьем является серы. Следовательно, для того чтобы производство серной кислоты из серы было экономически целесообразно, должна быть разработана схема, в которой стоимость ее переработки будет существенно ниже стоимости переработки колчедана или отходящих газов.
Получение серной кислоты включает несколько этапов. Первым этапом является получение диоксида серы окислением (обжигом) серосодержащего сырья (необходимость в этой стадии отпадает при использовании в качестве сырья отходящих газов, так как в этом случае обжиг сульфидов является одной из стадий других технологических процессов). Следующий этап – превращение оксида серы (IV) в оксид серы (VI). Этот окислительный процесс характеризуется очень высоким значением энергии активации, для понижения которой необходимо, как правило применение катализаторов. В зависимости от того, как осуществляется процесс окисления SO2 в SO3, различают два основных метода получения серной кислоты.
В контактном методе получения серной кислоты процесс окисления SO2 в SO3 проводят на твердых катализаторах.
Триоксид серы переводят в серную кислоту на последней стадии процесса – абсорбции триоксида серы, которую упрощенно можно представить уравнением реакции:
SO3 + h3Oà h3SO4
При проведение процесса по нитрозному (башенному) методу в качестве переносчика кислорода используют оксиды азота.
Окисление диоксида серы осуществляется в жидкой фазе и конечным продуктом является серная кислота:
SO2 + N2O3 + h3O à h3SO4 + 2NO
В настоящее время в промышленности в основном применяют контактный метод получения серной кислоты, позволяющий использовать аппараты с большей интенсивностью.
При подготовке данной работы были использованы материалы с сайта http://www.studentu.ru
Дата добавления: 27.11.2002
www.km.ru
Презентация по Химии "Серная кислота – хлеб химии"
Презентация на тему: Серная кислота – хлеб химииСкачать эту презентацию
Скачать эту презентацию
№ слайда 1 Описание слайда:Серная кислота – хлеб химии h3SO4Серная кислота широко используется в промышленном производстве. Она оказывает вредное воздействие на глаза и вызывает ожоги кожи.
№ слайда 2 Описание слайда:Царская водка: Царская водка-это не алкогольный напиток, а весьма сильный растворитель. Он состоит из смеси концентрированных кислот: азотной HNO3 (1 объём) и соляной HCl (3 объёма).Царская водка представляет из себя жидкость жёлтого цвета, пахнущую хлором и оксидами азота. Является сильнейшим окислителем благодаря выделению хлора и хлористого нитрозила в результате реакций: 3HCl + HNO3 = Cl2 + NOCl + 2h3O 2NOCl = 2NO + Cl2
№ слайда 3 Описание слайда:1270 году итальянский алхимик кардинал Джованни Фаданци, подбирая жидкие смеси для получения универсального растворителя, слил вместе концентрированные соляную и азотную кислоты и попробовал действие этой смеси на порошок золота. Золото на его глазах исчезло...Взволнованный Бонавентура не мог устоять на ногах. "Неужели универсальный растворитель получен?" - подумал он. Смесь была названа "царской водкой" за ее способность растворять "царя металлов" - золото.
№ слайда 4 Описание слайда:Одно из самых важных свойств золота- его исключительно высокая химическая стойкость. На него не действуют ни кислоты, ни щёлочи. Лишь грозная «царская водка» способна растворить золото. Этим обстоятельством однажды воспользовался известный датский физик лауреат Нобелевской премии Нильс Бор.
№ слайда 5 Описание слайда:В 1943 году, спасаясь от гитлеровских оккупантов, он вынужден был покинуть Копенгаген. Но у него хранились две золотые Нобелевские медали его коллег – немецких физиков-антифашистов Джеймса Франка и Макса фон Лауэ ( медаль самого Бора была вывезена из Дании раньше). Не рискуя взять медали с собой, учёный растворил их в «царской водке» и поставил ничем не примечательную бутылку подальше на полку, где пылилось много таких же бутылок и пузырьков с различными жидкостями. Вернувшись после войны в свою лабораторию, Бор прежде всего нашёл драгоценную бутылку. По его просьбе сотрудники выделили из раствора золото и заново изготовили две медали.
№ слайда 6 Описание слайда:Соляная кислота Соляная кислота — важнейший продукт химической промышленности. Она идёт на получение хлоридов различных металлов и синтез хлорсодержащих органических продуктов.Соляную кислоту применяют для травления металлов, для очистки различных сосудов, обсадных труб буровых скважин от карбонатов, оксидов, осадков и загрязнений. В металлургии ею обрабатывают руды, в кожевенной промышленности — кожу перед дублением. Соляная кислота — важный реактив в лабораторной практике. Газообразный HCl токсичен. Длительная работа в атмосфере HCl вызывает катары дыхательных путей, разрушение зубов, изъязвление слизистой оболочки носа, желудочно-кишечные расстройства.
№ слайда 7 Описание слайда:Азотная кислота Сфера применения азотной кислоты и её производных в настоящее время весьма обширна. Но прежде чем заняться рассмотрением этого вопроса, заглянем в историю. Ещё в древнем мире громкую славу приобрела селитра- калиевая соль азотной кислоты. При нагревании все нитраты разлагаются, выделяя атомный кислород, а он резко стимулирует горение. Например, сера и уголь горят медленно, но в смеси с селитрой сгорают за доли секунды. Если же эту смесь поместить в закрытый сосуд и поджечь, то произойдёт взрыв.Видимо, люди заметили это давно, так как подобную смесь, называемую сейчас порохом, применяли ещё в древности. Достоверно известно, что китайцы в 1237 г. при защите Пекина от монголов использовали пороховые бомбы, сбрасывая их на головы завоевателей. С появлением огнестрельного оружия применение пороха резко возросло, потребление селитры заметно увеличилось. Несколько веков азотную кислоту и её соли использовали в войнах и для разрушений, так как они были основой для изготовления пороха. Но постепенно появились у них и мирные сферы применения. К настоящему времени основным потребителем азотной кислоты стала не военная промышленность, а производство удобрений.
№ слайда 8 Описание слайда:Угольная кислота. Открывая бутылку лимонада, “Пепси-колы” или любого другого газированного напитка, мы также сталкиваемся с кислотой. Это угольная кислота. Как часто предательски вырывается она из бутылки, разбрызгиваясь вокруг. Это происходит потому, что молекулы её крайне неустойчивы, а в бутылке она находится под большим давлением, когда мы открываем крышку, она сразу разлагается h3CO3 = h3O + CO2 Угольная кислота – это тот редкий случай вещества, формулу которого принято считать условной, то есть такой молекулы не существует.
№ слайда 9 Описание слайда:Органические кислотыУксусная кислота Уксусная кислота содержится в уксусе Ее можно получить при брожении яблочного сидра.
№ слайда 10 Описание слайда:Немало кислот в нашей пище. Фрукты, овощи,содержат яблочную, лимонную, винную кислоты.
№ слайда 11 Описание слайда:Молочная кислота: друг или враг? При образовании сахара в молоке образуется молочная кислота. Она окисляет молоко, но также используется в производстве сыра
№ слайда 12 Описание слайда:Кислоты в организме человека Общее количество кислот, вырабатываемое ежедневно нашим организмом, велико и соответствует по кислотности двум-трём литрам концентрированной соляной кислоты. От количества кислот в организме зависит состояние здоровья, работоспособность и даже настроение.
№ слайда 13 Описание слайда:Желудочныйсок
№ слайда 14 Описание слайда:Нуклеиновые кислоты: ДНК на службе человекаДНК является носителем генетической информации. С молекулами ДНК связаны два основополагающих свойства живых организмов – наследственность и изменчивость.Фридрих Иоганн Мишер (1844—1895) — швейцарский физиолог, гистолог и биолог, открыл нуклеиновые кислоты
№ слайда 15 Описание слайда:Структура нуклеиновой кислоты
ppt4web.ru
Производство серной кислоты - химия, уроки
Тема: Производство серной кислоты.
Цель: 1. Актуализация знаний, подведение итогов.
2. Научить учащихся самостоятельности.
3.Привить чувство ответственности.
I. Организационный момент.
II. Мини-доклад о производстве серной кислоты.
Серная кислота – хлеб химической промышленности.
Ещё Д. И. Менделеев писал: « Едва ли найдётся другое искусственно добываемое вещество, столь часто применяемое в технике, как серная кислота. Где нет заводов по её добыванию – невозможно выгодное производство других веществ ».
Получать серную кислоту стали давно, ещё в средние века. Человечество проделало огромный путь, пройдя от стеклянных баллонов к кубкообразным камерам. В Шотландии применяли свинцовые камеры (отсюда название «камерный» процесс).
Башенные способы появились впервые в Германии в 1906году.
В середине XIX в. немецкий химик и инженер Рудольф Книч поставил перед собой «великую цель» замены камерного способа контактным. Впервые способ получения h3SO4 ложится на «современные рельсы». В России впервые контактный завод был построен в 1897году.
III Распределение ролей членов экспертной комиссии, лаборантов (2чел.), аппаратчиков (2чел.), технологов (2чел.), экономистов (2чел.). Учащимся предлагается по ходу урока заполнить аттестационные листы.
Аттестация.
Аттестация экономистов.
а) Решение задачи. Какова масса h3SO4, которую можно получить из 16т руды, содержащей 60% пирита (FeS2)?
б) В городе находится завод по производству h3SO4 . В соседней области имеются два горно-обогатительных комбината по добыче серы и пирита. Какой вид сырья вы выберете? И почему? (Пирит, как более дешевый).
в) Подберите синоним слову интенсивный. (Усиленный, напряженный процесс, совершаемый с неослабным напряжением).
г) Как вы понимаете термины: 1. Интенсификация производства (развитие производства на основе применения передовых методов организации труда, достижений научно- технического прогресса.
Интенсификация производства требует меньше капиталовложений, чем строительство нового завода.)
Комплексное использование сырья ( использование природного сырья, при котором все входящие вещества используются поместно. )
Аттестация лаборантов.
а) Каковы обязанности лаборантов?
(Уметь делать анализ веществ, устанавливать концентрацию растворов, рассчитывать данные анализа.)
б) Найдите предметы одежды и труда лаборанта.
(Белый халат, колбы, стаканы, микроскоп, штатив с пробиркой.)
в) В чем суть реакции нейтрализации?
г) Назовите качественную реакцию на серную кислоту. Запишите уравнение реакции.
д) Какую окраску имеет фенолфталеин в щелочах?
е) Определите наличие h3SO4 , NaOH, NaCl в пробирках. Прикрепите этикетки.
ж) Какова допустимая доза SO2 в воздухе помещения допустимая доза сернокислого тумана.
(Не более 1м2/м3, не более 0,006м2/л.)
Аттестация аппаратчиков.
а) Что должен знать аппаратчик (устройство и принцип действия электротехнической аппаратуры, радиоэлектронных приборов, основы вычислительной техники.)
б) Назовите соединения серы с кислородом.
в) Что такое олеум?
г) Назовите соединение серы с водородом.
д) Выберите предметы труда и одежды аппаратчика.
(Черный халат, каска, противогаз, шланги, гаечный ключ, защитные очки.)
е) Какие меры предосторожности нужно соблюдать при работе с серной кислотой?
ж) Выберите вещества, которые используются при оказании первой помощи при попадании серной кислоты на тело.
(h3O, 5% р-р соды, вазелин.)
з) Как предотвратить загрязнение окружающей среды на сернокислом заводе.
(Путем герметизации аппаратуры, применением газоочистительных установок.)
Аттестация технологов.
а) Как осуществляется процесс превращения пирита в серную кислоту?
б) Решите ситуационные задачи:
В первом контактном аппарате уменьшился выход оксида серы (VI), во втором - замедлилась скорость реакции. Какие меры надо предпринять, и какую команду вы дадите на пульт управления процессом?
В первой системе поглотительных башен появился сернокислый туман, во второй – понизилась концентрация олеума. Ваши ориентировочные действия и рекомендации операторам. (Увеличить концентрацию h3SO4 до 98,3%).
в) Почему контактный аппарат так называется?
IV Заключительная часть.
Выбор лучшего по профессии, вручение «удостоверений» «специалистам».
Выставление оценок членам «экспертной комиссии».
V Оформление кабинета. Оборудование.
Над доской лозунг: «Серная кислота – хлеб химической промышленности», плакат «Применение серной кислоты».
На стене плакат: «Производство серной кислоты».
На отдельном столе белый и черны халаты, каска, противогаз, штатив, микроскоп, колбы, аппарат Киппа, ступка, пестик, спички, спиртовка, ножовка, гвозди, молоток.
На демонстративном столике:
а) растворы h3SO4, NaOH, NaCl, BaCl2, фенолфталеин.
Б) раствор соды 5%, вода, вазелин.
На столах учащихся аттестационные листы.
Аттестационный лист.
При какой tпроисходит обжиг пирита? (8000С).
При какой t протекает реакция в контактном аппарате? (5000С).
Сколько времени требуется для обжига пирита? (несколько секунд).
Какой принцип используется в сушильной башне и поглотительной башне? (принцип противотока).
Какой катализатор используется в контактном аппарате и почему? (V2O5 дешевле платинового, продуктивнее Fe 2O3).
Процесс производства серной кислоты прерывный или непрерывный? (непрерывный).
Какова концентрация h3SO4 , применяемой в поглотительной башне? (98,3%).
Почему для орошения поглотительной башни применяется не вода, а концентрированная серная кислота? (чтобы не образовался сернокислый туман).
Какой из аппаратов в производстве называют «сердцем» сернокислого производства? (контактный аппарат, т. к. от его надёжности зависит конечный результат).
10. Применение h3SO4? (в нефтяной промышленности (очистка нефтепродуктов), в машиностроении (травление металлов), в цветной металлургии (получение меди, цинка, кобальта, никеля), в производстве взрывных веществ, в лёгкой промышленности (отбелка тканей, ситцепечатание, дубление кож), в сельском хозяйстве (производство минеральных удобрений, борьба с сорняками).
kopilkaurokov.ru



















