Солодово-дрожжевой агар с 40% сахарозы. Дрожжи осмофильные
Вредные микроорганизмы и возможности их проникновения в кондитерское производство
Основным источником вредных микроорганизмов является сырье, в значительно меньшей степени - аппаратура и оборудование, а также нарушение санитарных требований и правил обслуживающим персоналом.
Для изготовления кондитерских изделий используется самое разнообразное сырье и полуфабрикаты: сахар, молоко, сливки, пущенное молоко, сливочное масло, яйца, мука, какао бобы, фрукты, ягоды и продукты их переработки, орехи и др.
Сахар.
Сахар представляет собой основное сырье. Он входит в состав всех кондитерских изделий. По органолептическим и химическим показателям сахар должен удовлетворять требованиям действующего ГОСТа. Влажность сахара-песка при выпуске не превышает 0,05-0,10 %, а содержание микроорганизмов в 10 г сахара допускается не более 200 клеток. Однако при повышении влажности сахара в процессе хранения или при наличии посторонних примесей и загрязнений количество микроорганизмов значительно увеличивается и может достигнуть нескольких тысяч на 10 г.
В сахаре часто обнаруживаются осмофильные дрожжи и споры бактерий, как мезофилов, так и термофилов. Эти микроорганизмы, попав вместе с сахаром в подварки, пюре, сбивные начинки или при хранении в готовый продукт (конфеты, карамель), приводят к их порче, например к брожению и закисанию начинки. Особенно опасными для хранящейся продукции считаются бактерии, образующие сероводород и другие газы. В некоторых странах существуют нормы на содержание этих бактерий: в 10 г сахара-песка допускается не более 50-75 клеток. Кроме того, в сахаре часто встречаются капсульные, бесспоровые молочнокислые бактерии рода Лейконосток. При несоблюдении санитарных условий хранения в сахар могут попасть и патогенные микробы. Вся эта микрофлора представляет опасность, особенно при нарушениях технологического режима заготовки полуфабрикатов и в процессе дальнейшего их хранения.
Молоко, сливки.
Молоко и сливки являются полноценной питательной средой, и микроорганизмы, попавшие в них извне, быстро размножаются и обсеменяют продукты. Источников загрязнения много, но в основном к нему приводит низкий санитарный уровень производства на фермах и в молочных хозяйствах. Действующий стандарт допускает наличие во фляжном молоке, обычно используемом в производстве, не более 300 000 микроорганизмов в 1 мл. Однако при неправильных условиях хранения и перевозки (повышенная температура, грязная тара и др.) количество их в молоке быстро увеличивается.
Особую опасность представляют болезнетворные бактерии, устойчивые к воздействию технологических режимов, например при изготовлении кремов. Это - в первую очередь стафилококк золотистый, попадающий в молоко и сливки от больных маститом коров или с рук обслуживающего персонала на ферме, больного гнойничковыми заболеваниями, ангиной и др. Этот микроорганизм быстро размножается и выделяет энтеротоксин.
Он устойчив к нагреванию, выдерживает кипячение в течение нескольких минут, а токсин разрушается только после 2 ч кипячения. При размножении стафилококка признаков порчи в продукте не наблюдается, но продукт и изделия из него опасны для здоровья В молоке и сливках сохраняются и могут явиться причиной заболеваний бактерии родов Сальмонелла и дизентерийные палочки (при несоблюдении санитарных правил), туберкулезные бактерии и бруцеллы (при заболевании коров). Все эти бактерии погибают при высокой температуре, например при варке шоколадной массы, сливочных начинок, но могут остаться жизнеспособными при изготовлении кремов.
Сгущенное молоко с сахаром.
Этот продукт не подвергается воздействию высоких температур в процессе изготовления. Сгущение происходит под вакуумом при температурах 50-60 °С. Консервирующую роль играет сахар и повышенная концентрация сухих веществ. В сгущенное молоко микроорганизмы попадают из исходного молока и сахара, и чем выше степень обсеменения этих продуктов, тем больше их будет в сгущенном молоке. Сгущенное молоко должно удовлетворять требованиям действующего стандарта.
В соответствии с Перечнем СЭВ от 1982 г. в этих продуктах проверяют содержание мезофильных бактерий и бактерий группы кишечной палочки.
Хранящееся сгущенное молоко, особенно расфасованное в большие банки, может заплесневеть: на поверхности продукта при вскрытии банки обнаруживаются зеленые, черные, темно-коричневые пятна в виде «пуговиц». Реже молоко может прогоркнуть под влиянием жизнедеятельности жирорасщепляющих микрококков, обычно попадающих из исходного молока.
Сливочное масло.
В сливочном масле содержится значительное количество микроорганизмов, перешедших из свежих или заквашенных сливок. Это главным образом молочнокислые бактерии, но имеются и посторонние микроорганизмы. Находятся и размножаются они главным образом в плазме, в которой содержится в растворенном состоянии большое количество питательных веществ.
При хранении количество и состав микрофлоры масла меняются, в результате ухудшаются вкус и другие показатели продукта, наступает его порча. В процессе хранения при положительной (около 5 °С) температуре количество бактерий в масле увеличивается иногда в сотни тысяч раз. Появляются различные пороки, например рыбные вкус и запах - результат жизнедеятельности некоторых спорообразующих бактерий. При размножении дрожжеподобных грибов наблюдается прогоркание и появление тухлого запаха. Распространенным пороком является плесневение, которое может появляться при хранении в сыром помещении даже при отрицательной температуре (от -2 до -4 °С). Масло при этом прогоркает, появляется запах плесени. Использование масла с вышеописанными пороками не допускается.
Яйца, меланж, яичный порошок.
Свежие яйца и полученный из них меланж могут содержать патогенные микроорганизмы. Так, яйца кур, больных туберкулезом, могут содержать возбудителей этой болезни, а яйца водоплавающей птицы - гусей и уток, даже только что снесенные, могут быть заражены сальмонеллой. В меланже кроме вышеперечисленных микроорганизмов могут содержаться и дизентерийные палочки, попавшие при несоблюдении санитарных правил. Все эти микробы не образуют спор и погибают при температуре 100-120 °С. Поэтому куриные яйца при подозрении на туберкулез и яйца водоплавающей птицы не допускаются для использования при изготовлении кремов, которые готовятся при слабом нагреве. Такие яйца могут быть использованы для изготовления печенья, выпекаемого при высокой температуре. При использовании яиц водоплавающей птицы необходимо соблюдать специальные меры предосторожности.
В соответствии с Перечнем СЭВ от 1982 г. во всех этих припасах проверяют наличие в меланже мезофильных бактерий, аэробных и анаэробных, бактерий группы кишечной палочки, сальмонелл и золотистого стафилококка; в яичном порошке - всех вышеперечисленных микроорганизмов и плесеней.
Мука.
Мука должна соответствовать требованиям действующего стандарта. Испорченная мука, прогорклая, с повышенной кислотностью, запахом плесени, в производство не допускается.
Плодово-ягодные полуфабрикаты (подварки, начинки, пюре).
Вредные микроорганизмы, вызывающие порчу этих продуктов в процессе хранения, обычно попадают из сырья - фруктов, ягод, сахара, а также в процессе изготовления при нарушении технологических режимов или санитарных правил (плохо вымытая аппаратура). Наиболее часто порче подвергается яблочное пюре, в котором размножаются дрожжи-сахаромицеты, вызывающие спиртовое брожение, дрожжеподобные грибы и плесени, уничтожающие сахар и придающие продукту неприятные вкус и запах.
Под воздействием молочнокислых и уксуснокислых бактерий продукт может закиснуть.
Повидло содержит больше сахара и дольше варится, поэтому более устойчиво при хранении, однако и в нем может наблюдаться брожение, вызываемое дрожжами, устойчивыми к высоким концентрациям сахара, - осмофилами. Очень часто наблюдается плесневение. Для борьбы с порчей пюре и повидла в них добавляют консерванты-антисептики - сернистую или сорбиновую кислоту. Для удаления сернистой кислоты продукты перед употреблением прогревают. Содержание сернистой кислоты в готовых изделиях не должно превышать 20 мг/кг.
Крахмальная патока и пчелиный мед.
В этих продуктах размножаются и вызывают их порчу те же микроорганизмы, что и в плодово-ягодных припасах. Это осмофильные дрожжи, вызывающие спиртовое брожение, и молочнокислые бактерии, вызывающие закисание.
Какао бобы.
Какао бобы являются исходным сырьем для приготовления какао масла и какао порошка, которые используются в производстве шоколада и шоколадных конфет. При длительном хранении какао бобы могут подвергнуться порче.
Чаще всего наблюдается плесневение. Обычно развиваются различные виды родов Аспергиллус и Пенициллиум. Встречается и молочная плесень, а также и дрожжеподобные грибы. Плесневение значительно снижает качество какао бобов. Для борьбы с плесневением их следует хранить в сухих, хорошо проветриваемых помещениях. Лучшей сохранности какао бобов способствует их предварительная ферментация и обжарка.
Продукты, в которых обнаружены пороки, не допускаются для использования в производстве.
Борьба с порчей различных видов сырья заключается в соблюдении условий и сроков хранения, требуемых технологических режимов и санитарных требований при изготовлении полуфабрикатов.
Штамм дрожжей saccharomyces cerevisiae 1039, обладающий осмофильными свойствами, для получения спирта
Штамм Saccharomyces cerevisiae 1039, ВКПМ Y-3327, обладающий осмофильными свойствами, для получения этилового спирта из зернового сырья при сбраживании высококонцентрированного сусла. Штамм получен в результате селекции и мутагенеза из известного штамма Saccharomyces cerevisiae ВКПМ Y-3136. Это позволяет повысить производительность спиртового производства, сократить расход воды и выход послеспиртовой барды. 4 табл.
Изобретение относится к спиртовой промышленности, а именно к созданию нового штамма спиртовых дрожжей Saccharomyces cerevisiae 1039 (ВКПМ Y-3327), обладающего осмофильными свойствами и способного сбраживать зерновое сусло с концентрацией сухих веществ выше 30%. Штамм получен селекцией из известного штамма Saccharomyces cerevisiae Y-3136 путем многоступенчатой селекции с использованием эффективных методов мутагенеза. Изобретение обеспечивает эффективность сбраживания высоконцентрированных зерновых сред с образованием этилового спирта в бражке более 15,0 об.%.
Биотехнологической основой спиртового производства являются процессы конверсии высокомолекулярных полимеров растительного сырья для последующей микробной трансформации сахаров в этанол.
Одним из способов повышения рентабельности спиртового производства является использование высококонцентрированного зернового сусла с последующим сбраживанием его дрожжами, обладающими высокой осмофильностью. Поэтому получение и применение дрожжей, толерантных к основному продукту их жизнедеятельности (этанолу), - одна из возможностей интенсифицировать биохимические процессы спиртового брожения. Кроме того, сбраживание концентрированных сред способствует снижению выхода послеспиртовой барды - одного из вторичных продуктов спиртового брожения.
Важным фактором, определяющим эффективность спиртового производства, является физиологическая активность дрожжевых клеток. Плотность дрожжевой популяции, бродильная активность и продуктивность дрожжей оказывают существенное влияние на стабильное протекание процесса брожения, скорость сбраживания крахмалсодержащего сырья и выход целевого продукта.
В процессе жизнедеятельности дрожжей, их внутрипопуляционного регулирования роста возникают не зависящие от микроорганизмов факторы, негативно влияющие на физиологическое состояние дрожжевых клеток. К этим факторам можно отнести создаваемые извне или возникающие в процессе жизнедеятельности дрожжей условия субстратного лимитирования, ингибирования продуктами метаболизма, высокими концентрациями среды и др. В результате происходят необратимые процессы, негативно сказывающиеся на росте и размножении дрожжей, их качестве, что, в конечном итоге, приводит к снижению бродильной активности клеток и технологических показателей процесса брожения. Продолжительная генерация промышленных рас дрожжей ведет также к ослаблению культур и утрате их технологических возможностей.
В связи с этим селекция новых дрожжевых штаммов, обладающих повышенной осмофильностью и спиртоустойчивостью, актуальна.
Известны штаммы спиртовых дрожжей Saccharomyces cerevisiae 985-T и 987-O [1, 2]. По сравнению с известной промышленной расой Saccharomyces cerevisiae XII, а также Saccharomyces cerevisiae Y-319 [3], сбраживающими зерновое сусло с концентрацией сухих веществ 16-18% и выдерживающими концентрацию спирта до 12 об.%, они обладают способностью к сбраживанию более концентрированного зернового сусла (20-28% СВ).
Наиболее близким к заявляемому объекту является штамм Saccharomyces cerevisiae Y-3136 [4], обладающий осмофильными свойствами и применяющийся в качестве средства, снижающего образование побочных метаболитов в процессе получения спирта. При сбраживании осахаренного ячменного сусла с концентрацией сухих веществ 26% с использованием этого штамма в бражке через 72 часа брожения образуется 13,1 об.% этанола.
Недостатком штамма Y-3136 является неполное сбраживание им сусла с концентрацией сухих веществ выше 30% и отсутствие у него устойчивости к высоким концентрациям спирта в бражке (более 14,0 об.%).
Задачей, поставленной настоящим изобретением, является получение штамма спиртовых дрожжей Saccharomyces cerevisiae, обладающего способностью сбраживать осахаренное зерновое сусло с концентрацией сухих веществ выше 30% и повышенной устойчивостью к продукту своей жизнедеятельности - этанолу.
Технический результат, получаемый от использования нового штамма дрожжей Saccharomyces cerevisiae 1039 (ВКПМ Y-3327), заключается в повышении эффективности спиртового производства за счет сбраживания высоконцентрированного сусла, увеличения выхода спирта, существенной экономии воды на производстве, значительного сокращения выхода послеспиртовой барды.
Задача решается созданием нового осмофильного штамма дрожжей путем селекции и мутагенеза из известного штамма Saccharomyces cerevisiae Y-3136.
Заявляемый штамм Saccharomyces cerevisiae 1039 получен путем многоступенчатой селекции и мутагенеза с использованием эффективных химических и физических мутагенов; депонирован в ВКПМ под регистрационным номером Y-3327.
В результате мутагенеза после неоднократного отбора и рассева вариантов был получен штамм спиртовых дрожжей Saccharomyces cerevisiae 1039, обладающий высокой продуктивностью и бродильной способностью к сбраживанию осахаренного крахмалсодержащего сусла с концентрацией сухих веществ 30-36%.
Изучали способность сбраживать зерновое осахаренное сусло путем выращивания заявляемого штамма на высоконцентрированных жидких средах в стационарных условиях. Сравнительные технологические показатели (концентрация РВ, спирта, сумма побочных метаболитов в бражке) штамма Saccharomyces cerevisiae 1039 с прототипом представлены в табл.1.
Таким образом, в результате селекции и мутагенеза получен новый штамм Saccharomyces cerevisiae 1039, обладающий осмофильными свойствами, что позволяет повысить технологичность процесса сбраживания осахаренного зернового сусла с концентрацией сухих веществ выше 30%. Штамм отличается от известного и по культурально-морфологическим признакам.
Штамм хранится в виде лиофильно высушенной культуры и на косяках с сусло-агаром в отделе биотехнологии ферментных препаратов в пищевой промышленности государственного научного учреждения ВНИИ пищевой биотехнологии Россельхозакадемии г.Москвы.
Штамм Saccharomyces cerevisiae 1039 характеризуется следующими свойствами.
Культуральные признаки. На 4 суток роста при 30°С поверхность колонии на сусло-агаре однородная, блестящая, наблюдается радиальная складчатость; профиль колонии слегка выпуклый, форма колонии округлая; края колонии волнистые, цвет молочный; диаметр колонии 18×18 мм.
Морфология штамма. Размер клеток в бродящем солодовом сусле 2×2 - 6×6 мкм.
Физиолого-биохимическая характеристика. Тип катабализма - дыхание. Отношение к кислороду - анаэроб. Оптимальная температура роста 30-32°С.
Штамм непатогенен.
Штамм Saccharomyces cerevisiae 1039 использовали для сбраживания осахаренных крахмалсодержащих сред с концентрацией сухих веществ выше 30%.
Изобретение характеризуется следующими примерами.
Пример 1. Для проведения брожения используют осахаренное ржаное сусло концентрацией сухих веществ 30%. Сусло готовят из помола пшеницы с последующим развариванием при 1,5 атм. в течение 1,5 часов. Сусло осахаривают с добавлением в него ферментов - источников α-амилазы, глюкоамилазы, ксиланазы и грибной протеазы из расчета 2,5 ед. АС/г, 12 ед. ГлС/г, 0,15 ед. КС/г и 0,1 ед. ПС/г крахмала сырья. Осахаренное сусло засевают дрожжами Saccharomyces cerevisiae расы Y-3136 и 1039 в количестве 20 млн/см3 среды и проводят процесс брожения при 30°С в течение 72 часов.
В данных условиях заявляемый штамм заканчивает брожение на 6 часов раньше, чем в контрольном варианте, накапливая при этом больше этанола на 1,1 об.%. В таблице 1 приводятся данные сопоставительного анализа заявляемого штамма 1039 и штамма Y-3136.
| Таблица 1Сравнительная оценка физиологической активности дрожжей Saccharomyces cerevisiae при сбраживании пшеничного сусла | ||
| Показатель | Штамм дрожжей Saccharomyces cerevisiae | |
| Y-3136 | 1039 | |
| Длительность полного сбраживания сахаров | 72 часа | 66 часов |
| Этиловый спирт, об.% | 14,5 | 15,1 |
| РВ, г/100 см3 | 1,52 | 0,81 |
Пример 2. Для проведения брожения используют пшеничное сусло с концентрацией сухих веществ 33,5%. Сусло готовят из помола ржи с применением механико-ферментативной обработки. Сусло осахаривают с добавлением в него ферментов - источников α-амилазы, глюкоамилазы, ксиланазы и протеазы из расчета 1,0 ед. АС/г, 12 ед. ГлС/г, 0,2 ед. КС/г и 0,2 ед. ПС/г крахмала сырья. Осахаренное сусло засевают дрожжами Saccharomyces cerevisiae расы Y-3136 и 1039 в количестве 20 млн/см3 среды и проводят процесс брожения при 30°С в течение 72 часов.
В данных условиях заявляемый штамм заканчивает брожение на 6 часов раньше, чем в контрольном варианте, накапливая при этом больше этанола на 2,2 об.%. В таблице 2 приводятся данные сопоставительного анализа заявляемого штамма 1039 и штамма Y-3136.
| Таблица 2Сравнительная оценка физиологической активности дрожжей Saccharomyces cerevisiae при сбраживании ржаного сусла | ||
| Показатель | Штамм дрожжей Saccharomyces cerevisiae | |
| Y-3136 | 1039 | |
| Длительность полного сбраживания сахаров | 72 часа | 66 часов |
| Этиловый спирт, об.% | 14,5 | 16,7 |
| РВ, г/100 см3 | 2,37 | 0,88 |
Пример 3. В хорошо осахаренное зерновое сусло с концентрацией сухих веществ 30% вносят дрожжи Saccharomyces cerevisiae расы Y-3136 и 1039 в количестве 20 млн/см3 среды и проводят процесс брожения при 30°С. На 24 часа брожения в бродящее сусло вносят дополнительно 5 об.% этилового спирта и продолжают процесс брожения до 72 часов. В таблице 3 приводятся данные сопоставительного анализа заявляемого штамма 1039 и штамма Y-3136 на их спиртоустойчивость. Как видно из табл.3, заявляемый штамм S. cerevisiae 1039 выдерживает концентрацию спирта на 4,7 об.% больше, чем известный штамм.
| Таблица 3Сравнительная оценка спиртоустойчивости дрожжей Saccharomyces cerevisiae | |||||
| Раса дрожжей | Количество дрожжей, млн/см3 | Характеристика брожения | |||
| на 24 часа роста | на 48 часов роста | Спирт на 72 часа, об.% | Прирост спирта, об.% | ||
| всего | мертвых, % | ||||
| Y-31361039 | 120560 | 90380 | 5221 | 14,819,5 | 04,8 |
Пример 4. Для проведения брожения используют осахаренное пшеничное сусло концентрацией сухих веществ 29%. Сусло готовят из помола пшеницы с применением механико-ферментативной обработки. Осахаренное сусло засевают дрожжами Saccharomyces cerevisiae расы Y-3136 и 1039 в количестве 20 млн/см3 среды и проводят процесс брожения при 30°С. На 24 часа брожения в бродящее сусло вносят 8% глюкозы и продолжают брожение до 72 часов.
В таблице 4 приводятся данные сопоставительного анализа заявляемого штамма 1039 и штамма Y-3136. Концентрация спирта в бражке, синтезируемого заявляемым штаммом, превышает аналогичный показатель с применением известного штамма на 4,3 об.%.
| Таблица 4Сравнительная оценка физиологической активности дрожжей Saccharomyces cerevisiae при сбраживании пшеничного сусла | ||
| Показатель | Штамм дрожжей Saccharomyces cerevisiae | |
| Y-3136 | 1039 | |
| Продолжительность брожения, часы | 72 | 72 |
| Этиловый спирт, об.% | 13,9 | 18,2 |
| Количество дрожжей на 24 ч брожения | 96 | 595 |
| Количество дрожжей на 48 ч брожения | 64 | 740 |
| РВ, г/100 см3 | 5,21 | 2,34 |
Используемые источники
1. Римарева Л.В., Оверченко М.Б., Игнатова Н.И. Особенности применения термотолерантных и осмофильных дрожжей для интенсификации спиртового брожения //5-я Междунар. научно-практич. конференция «О состоянии и направлениях развития производства спирта этилового из пищевого сырья и ликероводочной продукции» М., Пищепромиздат, 2005, С.25-30.
2. Римарева Л.В., Оверченко М.Б., Игнатова Н.И., Останина Е.В., Погоржельская Н.С. Повышение эффективности спиртового брожения с использованием термотолерантных и осмофильных дрожжей// Теоретические и практические аспекты развития спиртовой, ликероводочной, ферментной, дрожжевой и уксусной отраслей промышленности. Сборник научных трудов. 75 лет ВНИИПБТ, М., 2006, С.39-43.
3. АС СССР №1045630, 30.12.1984 г.
4. Заявка №2005137211/13 (041526), 30.11.2005 (прототип).
Штамм спиртовых дрожжей Saccharomyces cerevisiae 1039, ВКПМ Y-3327, обладающий осмофильными свойствами, для получения спирта.
www.findpatent.ru
ЛЕКЦИЯ 3 - вспом. мат
ЛЕКЦИЯ 3
МИКРОФЛОРА ВСПОМОГАТЕЛЬНЫХ МАТЕРИАЛОВ ХЛЕБОПЕКАРНОГО, КОНДИТЕРСКОГО, МАКАРОННОГО ПРОИЗВОДСТВ.
Литература:
Елецкий И.К. Микробиология хлеба и мучных кондитерских изделий. – М.: Пищевая промышленность, 1967 г. – 104 с. Шифр 6П8.2 Е 50 инв. № 558905 хр.
Слюсаренко Т.П. Лабораторный практикум по микробиологии пищевых производств. – М.: Пищевая промышленность, 1984 г. – 206 с.
Мюллер Г., Литц П., Мюнх Г.Д. Микробиология пищевых продуктов растительного происхождения. Москва: Пищевая промышленность, 1977. 344 с. 6П8 М98 и.н. 805279.
Особенности микробиологии при производстве сахара
Сахар, кондитерские изделия и мёд принадлежат к пищевым продуктам, содержащим малое количество микробов. В связи с низким содержанием воды в этих продуктах и высоким осмотическим давлением сахарного раствора они поражаются лишь определёнными видами микроорганизмов, причём особую роль играют осмофильные дрожжи и плесневые грибы, а также бактерии родов Leuconostoc. Bacillus и Clostridium.
Свекольный сахар производится промышленностью из сахарной свёклы, содержащей 15-20 % сахарозы. Сахарный экстракт, который получают водной экстракцией из вымытой и измельчённой в стружку свёклы, является хорошей питательной средой для многих микроорганизмов. Микроорганизмы попадают в экстракционные установки прежде всего с остатками почвы, с промывной водой.
Мезофильные микроорганизмы сахара имеют при его получении ограниченное значение, так как процесс переработки осуществляется при высоким температурах. Они могут развиваться при остановках технологической линии по производству сахара, при нарушениях в режиме переработки свёклы в жомовой воде и в сыром экстракте при температурах ниже 50 °С. При нормальных условиях производства вред может быть нанесён только термофилами, так как они могут развиваться даже при температурах 72 °С, характерных для процесса производства сахара из свёклы.
В экстрактах играют роль прежде всего Bacillus stearothermophilus, температурный оптимум для которых составляет 75 °С и которые в виде спор могут переносить влажную жару при 118 °С в течение 75 мин. также может развиваться B. subtilis, температурный оптимум которых составляет 45 °С, но которые ещё могут развиваться и при температуре 55 °С. также в данном сырье могут появляться, как вредители также термофильные штаммы B. licheniformis, B. coagulans, Clostridium thermohydrosulfuricum и другие аэробные спорообразующие микроорганизмы.
Указанные виды микроорганизмов используют для своего метаболизма сахарозу, а значит являются сахаролитическими. В этом случае из сахарозы получается вода, углекислый газ, леван, молочная, уксусная, муравьиная кислоты, а также этиловый спирт. Данные трансформации сахара приводят к большим его потерям, как сырья.
Кроме спороносных бактерий могут встречаться термофильные виды рода Lactobacillus, оптимум развития которых составляет 50-55 °С. они образуют прежде всего молочную кислоту. Виды Leuconostoc весьма неприятны при образовании слизи (декстрана), кратковременно переносят температуру до 90 °С. но при температурах выше 43 °С они приостанавливают своё развитие.
Хранимоспособность сахарных сиропов зависит от их концентрации, температуры хранения, возможности доступа кислорода.
При варьировании концентрации СВ сиропа от 50 до 70 % количество микроорганизмов уменьшается. При концентрации 70 % и более развиваются только осмофильные грибы.
При температуре хранения от 2 °С до 15 °С количество микроорганизмов даже при небольшой концентрации веществ уменьшается.
При хранении сиропа недопускаются вегетативные микробы, нетермостойкие споры. Допускаются термостойкие споры в количестве 50 на 1 мл. содержание СВ – не менее 67 % и не более 69 %, рН должна быть кА можно выше около 8,5-9. температура хранящего сиропа должна составлять максимум 15 °С. Все технические устройства должны конструироваться так, чтобы исключать микробное инфицирование в процессе производства, а вначале и в конце производства можно было бы легко осуществлять очистку и дезинфекцию. Для предотвращения поражения гифомицетами следует через 4 недели (1 раз в месяц) опрыскивать поверхность хранящегося сиропа 30%-ным раствором формальдегида из расчёта 50 мл на 1 м2. также можно применять холод, химическое консервирование.
Источники заражение сахара-песка.
Содержание микробов зависит не столько от перерабатываемого сырья, сколько от технологии изготовления сахара. Играют также роль условия хранения и упаковка.
При получении свекольного сахара благоприятные условия для развития микроорганизмов создают теплая и влажная атмосфера сахарного завода, а также имеющиеся во многих местах пленки сахара сиропа. Бактерии и дрожжи могут размножаться на крышках, днищах, стенках, транспортных устройствах и загрязненных агрегатах для кристаллизации и подготовки, попадая прямым или косвенным путем в сахар. Число микроорганизмов может возрастать также при процессах охлаждения и сушки, например, в охлаждающих и сушильных барабанах или при псевдожижении, если нагнетаемый воздух предварительно не очищался от микроорганизмов. Термофильные аэробные микробы могут усиленно размножаться в разбавленных продуктах. Все производственные жидкости, содержащие сравнительно низкое количество сахара, обычно насыщенны микробами и прежде всего мезофилами.
Во время хранения белого сахара в зависимости от условий может происходить уменьшение, сохранение или возрастание количества микроорганизмов. При безупречных условиях количество микробов уменьшается. Так как вегетативные формы микробов погибают быстрее, чем длительно устойчивые формы, хранение ведёт к относительному возрастанию спор. Что бы слохранять белый сахар и сахарную пудру в состоянии, пригодном для хранения и продажи, содержание воды должно составлять менее 1 % в них. Это необходимо потому, что остаточная влага локализуется в тонком поверхностном слое на кристаллах сахара. Внутрь кристалла вода не проникает. Водная же оболочка состоит из концентрированного раствора сахара, который тормозит рост многих микроорганизмов. Только осмофильные организмы, прежде всего дрожжи и гифомицеты. Хранение сахара должно осуществляться при оптимальных условиях, в гигиенически безупречных помещениях с относительной влажностью воздуха 55-65 %, причём температура хранилища должна быть минимум на 2 °С выше среднесуточной. Дневные колебания температуры воздуха могут составлять максимум ±5 °С. дополнительным источником инфекции могут явиться упаковочные материалы. Они инфицируются прежде всего мезофильными микроорганизмами, но встречаются и термофильные
Содержание и виды бактерий сахара (кристаллической сахарозы)
Содержание бактерий в сахаре-сырце относительно высоко. Кристаллы покрыты тонким слоем межкристаллической жидкости, которая благоприятствует росту микробов в связи с содержанием органических веществ и минеральных солей. В свекловичном сахаре-сырце обнаруживают высокое содержание гифомицетов, в тросниковом кроме того, - большое количество осмофильных дрожжей. Из-за высокого содержания бактерий сахар сырец не может быть рекомендован для непосредственного употребления в пищу. Содержание бактерий в сахаре-песке сильно колеблется от 0 до 500 клеток на 1 г.
Порча, вызываемая микроорганизмами сахара при дальнейшей промышленной переработке и меры её предотвращения
Бактерии, дрожжи, плесневые грибы, встречающиеся на сахаре в различном количестве могут вызывать при дальнейшей переработке повреждение и порчу, прежде всего в кондитерской промышленности и производстве напитков, плодо- и овощеперерабатывающей промышленности, в пчеловодстве, а также в мясной и рыбной промышленности. В шоколадной и кондитерской промышленности применение сахара низкого качества может привести к порче готового продукта. Микроорганизмы, вызывающие газообразование, приводят к разрушению марципановых изделий из сахара. В пчеловодстве кормление пчёл сахаром с высоким содержанием осмофильных бактерий может вызвать гибель всех пчелиных семей. В случае порчи осмофильными дрожжами сгущённого молока с сахаром источником инфекции является сахар, содержащий бактерии, микроорганизмы.
Микробиология мёда
Мёд, добываемый пчёлами из нектара различных цветов или из сладких частей других растений, содержит около 70-80 % инвертного сахара, 20-25 % воды, до 5 % сахарозы, 0,3 % соединений азота, 0,1-0,2 % органических кислот и 0,1-0,35 % минеральных веществ. Величина рН мёда изменяется от 3,3 до 4,9. в связи с химическим составом, особенно высоким содержанием сахара и низким воды, мёд обычно достаточно стоек. Иногда он поражается осмотическими дрожжами, вызывающими пенное брожение. Бродящий с образованием пены мёд имеет своеобразный, сильно отличающийся от нормального запах и вкус. Однако изменение, обнаруживаемое путём химического анализа, незначительно. Пенное брожение мёда – очень медленно протекающий процесс спиртового брожения, вызываемый осмофильными дрожжами. Пенообразование вызывается углекислым газом, выделяющимся в ходе брожения, Предполагаемое декарбоксилирование муравьиной кислоты играет весьма незначительную роль. Спирт содержится в бродящем мёде в незначительных количествах.
Микробиология масел и жиров
По сравнению с многими видами пищевого сырья и вспомогательных материалов масла и жиры в меньшей степени подвержены микробной порче. Но подобно в отличии от других пищевых систем в комплексе пищ-х систем подвергаются порче быстрее чем другие. Моножировые и мономасляные системы меньше подвержены порче так как они не содержат воду, ограниченно минеральные вещества.
Порча масла – прогорклость
Прогорклость масел и жиров вызывается прежде всего гидролитическими и окислительными процессами, которые чаще всего протекают одновременно. При возникновении прогорклости жиросодержащих продуктов обычно нельзя определить, результат это только чисто химических превращений или же имели место и ферментативные процессы. Порча жиров ускоряется многими факторами, таким, как свет, кислород, влажность и ионы тяжёлых металлов, действующих каталитически, например Cu++. В процессах ферментативного расщепления могут участвовать не только микроорганизмы, разрушающие жиры, но и ферменты, содержащиеся в самих пищевых продуктах. Среди бактерий распространены виды, расщепляющие жиры, прежде всего в родах Bacillus, Pseudomonas, Micrococcus, Serratia, Proteus, Achromobacter. Данные микроорганизмы продуцируют липазы – ферменты разрушающие жиры. психрофильные виды Pseudomonas, Achromobacter имеют большое значение при порче продуктов, содержащих жиры и хранящихся на холоде. Среди дрожжей липолитические виды – Candida lipolytica (порча майонеза), Penicillium, Aspergillus, Geotrichum, Fusarium, Cladosporium. Так как данные формы в противоположность другим группам микроорганизмов менее требовательны к влажности, они играют большую роль при разрушении жиров и масел, а также пищевых продуктов с большим содержанием жиров, как орехи, майонезы, различных хлебобулочных изделиях. Для повышения стойкости продукта к прогоранию преимущественно для длительного хранения используют холод, который одновременно задерживает нежелательные химические изменения. Для маргаринов, за исключением некоторых малокалорийных сортов, содержание жира в которых должно составлять минимум 80 %, а содержание воды – максимум 20 %, разработаны специальные пастеризационные установки. При уничтожении микроорганизмов в жиросодержащих веществах термообработка должна быть много выше, чем в водных средах. Для майонезов, которые чувствительны к высокой и низкой температуре и в связи с их химическим составом (масло, сахар, яичный желток и др.) особенно легко разрушаются бактериями, дрожжами и гифомицетами, допускается в ограниченном количестве добавление химических консервантов, таких как бензойная кислота и её дериваты. Благоприятные условия создаёт герметичная упаковка, без воздуха в верхней части, так как разрушающие жир микробы являются в основном аэробами.
Источником микрофлоры сливочного масла являются свежие и сквашенные сливки, аппаратура, вода, соль, краски. В сладкосливочном масле обнаруживаются в основном те виды, которые попадают из сырья и в процессе выработки. В кислосливочном масле содержатся десятки миллионов микроорганизмов, преимущественно чистой культуры молочнокислых бактерий специальных заквасок, способствующих ароматизации масла, улучшающих вкус и повышающих его стойкость. В процессе хранения масла микроорганизмы размножаются в его плазме. Плазма – водный раствор белков, молочного сахара, молочной кислоты, солей и других веществ, ассимилируемых микробными клетками для своего развития. В результате происходит порча масла и появляются пороки. Пожелтение верхних слоёв масла (штафф) вызывают флуоресцирующие бактерии Pseudomonas fluorescens. Этому способствуют и окислительные процесс под действием кислорода воздуха. Горький вкус в масле появляется в результате размножения спорообразующих бактерий и псевдомонад, прогорклый вкус и тухлый запах вызывают дрожжи рода Candida, кокки Streptococcus faecalis var liquefaciens, мицелиальные грибы, протеолиические спорообразующие бактерии; поверхностное плесневение масла – грибы Penicillium glaucum, Endomyces lactis, реже – Cladosporium, Aspergillus, Mucor, глубинное плесневение – Cladosporium herbarum; появлению рыбьего (селёдочного вкуса) способствует активное развитие в плазме протеолитических бактерий.
Микрофлора пряностей
Хотя многие пряности содержат антимикробные вещества, они могут содержать и много микроорганизмов. Особенно высокое содержание микробов почти всегда наблюдается у чёрного перца, тогда как у большинства других пряностей оно не превышает миллиона. Мало микробов в гвоздике, горчичных зёрнах, мускатном орехе. Пряности содержат большое количество термостойких бактериальных спор. Среди споровых форм встречаются Bacillus subtilis, B. circulans, B. coagulans, B. licheniformis, анаэробные клостридии. Кроме стойких спор пряности содержат неспорообразующие микроорганизмы: стафилококки, стрептококки, представителей родов Pseudomonas, Flavobacterium, Alcaligenes, Klebsiella, Serratia и др. встречаются также актиномицеты. Как и в зерновые микроорганизмы попадают в пряности из почвы. Сушка, хранение, переработка являются другими источниками загрязнения, причём степень соблюдения гигиенических условий на всех ступенях производства увеличивается или уменьшается количество микробов в пряностях. Принципиально возможна стерилизация пряностей сухим жаром, однако при этом пряности частично теряют свою силу вследствие испарения летучих эфирных масел. Ультрафиолетовое облучение оказывается недостаточно действенным. Оно захватывает только микробов, находящихся на поверхности, так как лучи не проникают в более глубокие слои пряностей. Кроме того, происходит относительное увеличение количества устойчивых бактериальных спор, которые уничтожаются в меньшей степени, чем вегетативные микробы. Более эффективными оказываются катодные и рентгеновские лучи в связи с большей проникающей способностью. Так с помощью дозы облучения 300-400 крад количество микробов в молотом перце снижается на 99-99,9 %. Для уничтожения остаточной микрофлоры, которая состоит из устойчивых у лучам бактериальных спор, следует повышать дозу облучения до 1600-2000 крад. Применение лучей для удаления микробов пока не разрешается, так как пока не удаётся надёжно исключить образование токсичных веществ. Также пряности обрабатывают окисью этиленана, где на 1 м3 объёма с пряностями требуется 50 мл газа. За 6-7 часов окись этилена уничтожает при комнатной температуре большую часть микробов. Более высокие концентрации и увеличение времени действия ведут к изменению цвета и ухудшению аромата. Так как окись этилена проходит сквозь газонепроницаемый материал, она может применяться для уничтожения микробов в расфасованных пряностях. После хорошего проветривания расфасованных пряностей эти средства дезинфекции уже не обнаруживаются. Окись этилена эффективна не только против вегетативных клеток, но и против устойчивых спор, однако полное освобождение от микробов не достигается. Допустимое предельное число микробов в обработанных пряностях составляет 1000 на 1 г. У чёрного перца, который особенно насыщен спорами, в порядке исключения допускается 3000 микробов на 1 г.
Микрофлора молока, сгущённого молока, сливок
В преобладающем количестве в молоке присутствуют молочно-кислые микроорганизмы: сапрофитные кокки (Streptoccus lactis – молочный стрептококк, S. cremoris – сливочный стрептококк, S. thermophшlus –термофильный стрептококк), энтерококки (S. faecalis, S. faecalis var liquefaciens, S. bovis), палочки (lactobacillus helveticus, L. bulgaricus, L. acidophilus). Размножаясь в молоке, они вызывают скисание, вкус молока приятный, кислотватый. Только при развитии S. faecalis var liquefaciens (маммококки) молоко и молочные продукты приобретают горький вкус.
Также в молоке присутствуют маслянокислые бактерии – представители рода Clostridium. Данные виды микроорганизмов в пастеризованном и кипячённом молоке при длительном хранении на холоду образуют масляную кислоту, газы, неприятный запах и горький вкус.
Гнилостные микроорганизмы молока вызывают глубокий распад белков молока с выделением газов, появлением неприятного запаха и вкуса, иногда и ядовитых веществ. Консистенция молока при их развитии может стать тягучей, слизистой. К гнилостной микрофлоре молока отнесены аспорогенные палочки: Proteus vulgaris, Pseudomonas fluorescens, аэробные спорообразующие палочки – Bacillus subtilis, B. cereus, B. mycoides, B. megaterium и анаэробные спорообразующие виды B. putrificus, B. polymyxa.
К представителям группы кишечной палочки относят Escherihia coli, Citrobacter freundii, Enterobacter aerogenes. Данные представители свёртывают молоко с образованием газа, придают молоку резкий вкус и неприятный запах, иногда вызывают тягучесть.
Дрожжи, мицелиальные грибы встречаются в свежем молоке в незначительном количестве, но играют большую роль в производстве и хранении кисломолочных продуктов. В молочных продуктах грибы вызывают прогорклый вкус, обусловленный разложением белков и жира.
Патогенные бактерии, встречающиеся в молоке, разделяют на возбудителей инфекций, которыми заражает человек через молоко больных коров (бруцеллёз, ящур, мастит, туберкулёз, сибирская язва, коли-инфекция) и возбудителей токсикоинфекций и токсикозов, попадающих в молоко при антисанитарном доении, хранении и транспортировке (брюшной тиф, паратифы, бациллярная дизентерия, холера, стрептококковая инфекция, стафилококковое отравление). Патогенные бактерии при пастеризации и стерилизации молока, а также при варке шоколадной массы, сливочных начинок уничтожаются, но могут остаться жизнеспособными при изготовлении кремов.
В сгущённом молоке находятся микроорганизмы исходного молока и сахара, не погибшие в процессе сгущения под вакуумом при температуре 50-60 °С. Порчу сгущённого молока вызывают мицелиальные грибы Catenularia fuliginea. Они образуют на поверхности продукта шоколадно-коричневые комочки – «пуговицы». Молоко при этом приобретает неприятный сырный вкус. Плесневение сгущенного молока, фасованного в большие банки, вызывают мицелиальные грибы Penicilium glaucum – зелёня плесень и Cladosporium herbarum – чёрная гроздевидная плесенью. Большой вред также приносят осмофильные дрожжи, способные сбраживать сахара и вызывать разжижение. Микрококки, образующие окрашенные колонии, обладают активными липолитическими ферментами и могут вызвать разложение жира (прогорклое молоко), белков (сырный вкус).
Микрофлора яиц, меланжа, яичного порошка
Свежие куриные яйца зачастую стерильны. В процессе хранения они постепенно заражаются различными микроорганизмами. Мицелиальные грибы (Penicillium, Aspergillus, Mucor) проникают через поря скорлупы, вызывают порчу содержимого яйца и придают ему характерную окраску (зеленоватую, чёрную, жёлтую). Вслед за грибами яйца поражают гнилостные бактерии (Escherihia coli, Enterobacter cloacae, Enterobacter aerogenes, Pseudomonas fluorescens, Proteus vulgaris, Bacillus и др.), количество которыз возрастает при загрязнении скорлупы куриным помётом. Навозом. Размножаясь внутри яйца, бактерии вызывают гидролиз белка, затем проникают в желток. Разложение содержимого яйца сопровождается изменением его цвета и появлением неприятно пахнущих веществ и газа.
Меланж (смесь яичных желтков и белков, хорошо размешанная, профильтрованная и замороженная в специальной таре), содержит те же микроорганизмы, что и яйца. В меланже микроорганизмы очень быстро размножаются, поэтому хранят его в замороженном состоянии, а после оттаивания перерабатывают в течение 2-3 часов. В яйцах и особенно в меланже могут быть обнаружены патогенные бактерии – дизентерийная палочка, бактерии кишечно-тифозной группы (сальмонеллы). Сальмонеллы чаще проникают в яйца водоплавающей птицы и могут стать источником пищевых токсикоинфекций. Поэтому утиные и гусиные яйца разрешается использовать для выпечки мелкоштучных мучных изделий. в яичном порошке после высушивания до влажности 65 % остаются в жизнеспособном состоянии наиболее устойчивые виды гнилостных и пигментных бактерий, а также споры мицелиальных грибов.
Микрофлора кокао бобов
Так как какао бобы подвергают сушке, обжарке, ферментации, то микроорганизмов на них фактически не остаётся. Вторичное развитие микроорганизмов на поверхности какао бобов происходит в процессе длительного хранения, особенно при повышенной влажности. Их порчу могут вызвать мицелиальные грибы (Aspergillus, Penicillium, Endomyces), дрожжи Candida и др. Для предупреждения плесневения какао бобы хранят в сухом хорошо проветриваемом помещении.
Микрофлора фруктово-ягодных полуфабрикатов
В пюре, повидле, варенье в процессе хранения могут развиваться различные микроорганизмы, устойчивые к высокой температуре, кислотам и консервантам. Особенно подвержено порче пюре, для изготовления которого плоды после мойки и шпаривания протирают, добавляют консерванты. В пюре может происходить спиртовое брожение (Saccharmyces cerevisiae, S. vini и др.), уксуснокислое (Acetobacter) или молочнокислое закисание (Lactobacillus, Streptococcus). На его поверхности иногда появляется плёнка дрожжей и мицелиальных грибов (Candida, Torulopsis, Penicillium, Aspergillus, Mucor). В результате изменяется химический состав продукта, ухудшается вкус и запах. Повидло является более стойким, так как его упаривают после добавления сахара. Однако при неправильном хранении или в случае нарушения технологических режимов изготовления в готовом продукте могут происходить микробиологические процессы. Брожение повидла вызывают осмофильные дрожжи рода Saccharomyces. Их источником может стать сахар, загрязнённая тара и воздух. Плесневение повидла происходит при развитии на его поверхности мицелиальных грибов. Следствием указанных процессов является снижение количества сахара в продукте, появление постороннего вкуса и запаха.
13
studfiles.net
Выделение чистой культуры дрожжей
В зависимости от программы исследований выбирают тот или иной метод отбора образцов, позволяющий либо только обнаружить и количественно учесть дрожжевые организмы в анализируемом субстрате, либо обнаружить для накопления их биомассы. В разных областях научных исследований и каждой отрасли промышленности имеются свои указания относительно деталей правильного отбора проб для микробиологического анализа. (И.П. Бабьева, В.И. Голубев, 1979).
Поверхность твердого тела. Ее исследуют путем получения смыва, отпечатка или соскоба.
Смыв производят стерильной водой непосредственно с объекта, помещая его в сосуд или же при больших размерах объекта пользуясь ватными или марлевыми тампонами. Такие тампоны затем опускают в суспензионную жидкость, встряхивают и делают высев. Недостатки этого метода заключаются в том, что его, во первых, трудно стандартизовать (разные люди прикладывают разные усилия при смыве ) и во вторых, вата активно сорбирует клетки микроорганизмов и суспензия получается обедненной. Для количественного учета эта техника непригодна. Несмотря на указанные недостатки,различные методы смыва остаются на более распространенными в области медицинской и санитарной микробиологии, а также при изучении эпифитной флоры зеленых растений. В последнем случае используют непосредственный смыв без тампонов путем нанесения целых листьев или их частей в колбы с водой. При сравнительных исследованиях из листа вырезают пластинки стандартной площади, чтобы можно было сделать пересчет числа микроорганизмов на 1см 2 . листья или вырезанные из них пластинки встряхивают в колбе с водой 10 минут на качалке, а затем делают.
 Растирание материала, которое иногда рекомендуют, не всегда желательно, так как при этом освобождаются токсические вещества, фитонциды, которые могут оказать губительное действие на микробные клетки.
Растирание материала, которое иногда рекомендуют, не всегда желательно, так как при этом освобождаются токсические вещества, фитонциды, которые могут оказать губительное действие на микробные клетки. Метод смыва с поверхностей применяют при исследовании таких объектов, как плоды и овощи, зерно и сметана, мясо и шкуры и тому подобное, а также с оборудования.
Соскоб производят стерильным скальпелем непосредственно в сосуд со стерильной водой. Суспензию перед посевом либо встряхивают 10 минут, либо обрабатывают 5 минут на микроразмельчителе тканей.
Отпечатки приготовляют прямыми или опосредованными методами.
Прямые методы основаны на снятии дрожжевых клеток с исследуемой поверхности различными прозрачными адгезивными материалами: Коллодиевой пленкой бесцветным лаком, липкой целлофановой лентой, полиэтиленовой пленкой, смазанной клеящим веществом. Полученные отпечатки просматривают под микроскопом опуская пленки в капли воды или лактофенола на предметном стекле.
Липкой лентой можно снимать и предварительно нанесенную на поверхность объекта тонкую агаровую пленку. Полоску ленты с агаром и прикрепившимися к нему дрожжевыми клетками, рассматривают затем под микроскопом без проращивания. Методы получения отпечатков имеют некоторые общие недостатки: далеко не все клетки снимаются с исследуемой поверхности; при густой обсемененности клетки могут располагаться слишком близко друг от друга и их трудно учитывать. При получении отпечатка с последующим проращиванием исследуемый объект прижимают к поверхности плотной питательной среды, а затем его удаляют, и чашки со средой ставят в термостат. Таким образом удается хорошо наблюдать плотность заселения и характер распределения дрожжей на поверхности листовой пластинки. Если объект большого размера, то поступают наоборот: к нему прижимают приготовленную среду, пользуясь методом агаровой колбаски. Колбаски делают из разных питательных агаров, запечатывая их стерильно в пергаментную обертку. Срезая последовательно круглые ломтики, их 4 размещают в стерильные чашки Петри и проращивают во влажной камере.
Отпечатки можно получать с помощью мягких пластичных материалов, таких как бархат, замша, вельвет из которых делают круглые подушки - репликаторы. Лучше всего использовать - бархат велюр, белый или бледно желтый (другие краски могут быть токсичны).Бархат первоначально кипятят, режут круглые куски и приклеивают их к алюминиевым дискам такого размера чтобы они помещались в чашку Петри.
Стерилизую завернутыми в бумагу сухим жаром при 160оС 1 ч. Перед использованием поверхность бархата смачивают жидкой питательной средой и прикладывают его к исследуемому объекту на несколько секунд. Затем не сдвигая! Осторожно отнимаю и переносят в чашку Петри. Отпечатки делают на серии чашек с одной или разными средами. После употребления репликаторы стерилизуют в сосудах с водой автоклавированием 20 мин при 120оС, подсушивают и расправляют бархат шпателем. Особенно удобно пользоваться мягкими репликаторами при работе с неровными и шероховатыми поверхностями.
Сыпучие и плотные субстраты. Их берут для анализа в стерильные пергаментные пакеты. Влажные пробы отбирают в стерильные стеклянные банки или новые полиэтиленовые пакеты. Отбор проб ила со дна водоемов производят статометром, или дночерпателем. В других случаях пробы можно брать специальной ложкой, ножем или шпателем, которые предварительно протирают спиртом и обжигают.
При сборе образцов почв для экологического исследования соблюдают специальные правила, гарантирующие репрезентативной выборки.
Прозрачные жидкости и взвеси. Присутствие дрожжей в них можно установить непосредственно под микроскопом или после концентрирования на центрифугах при частоте вращения 2000 об/мин в течении 15-20 мин.
Пробу воды и жидкостей отбирают в стерильные сосуды. Воду из природных водоемов берут специальными приборами-батометрами. Из них воду фильтруют через мембранные фильтры с порами диаметром 1,2 мкм. Далее фильтры либо помещают на поверхность питательных сред для проращивания клеток дрожжей, либо окрашивают и наблюдают под микроскопом. Можно брать два фильтра: один для проращивания и окраски, а другой (нижний) для контроля на пропускание.
Масла и эмульсии, включая сливочное масло и мороженое, можно также исследовать методом мембранных фильтров после обработки их эмульгаторами. Жидкости и взвеси необходимо анализировать вскоре после отбора проб, а при невозможности этого хранить в холодильнике не более 1-2 сут, так как далее первоначальное количество дрожжей в них может существенно измениться.
Воздух. Методы анализа воздуха основаны либо на осаждении аэрозолей, либо на фильтрации его через жидкости или твердые фильтры.
Метод Коха основывается на свободном оседании микробных аэрозолей на поверхность питательной среды под влиянием гравитационных сил. Чашки со средой оставляют открытыми на 5-15 мин, а затем закрывают и помещают в термостат. Этот метод используют для обнаружения дрожжей в воздухе закрытых помещений при кратковременной экспозиции чашек. В открытых местах его использованию мешают горизонтальные потоки воздуха.
Все другие методы определения микроорганизмов в воздухе основан на принудительном его токе, который создается разными способами.
Для санитарно-микологического контроля окружающей среды на предприятиях по производству белково-витаминных препаратов и кормовых дрожжей количественный учет дрожжей – продуцентов рода Сandida рекомендуется проводить щелевым методом на сусло-агаре и МБС – метабисульфитном агаре (МПА + 0,2% метабисульфита натрия ) с добавлением биомицина в количестве 100000 ед/л. Рост продолжается 48ч при 37°.
Для фильтрации воздуха через жидкости используют прибор Киктенко, основанный на осаждении микробных клеток в улавливающей жидкости, которую затем переносят по 0,1 – 0,3 мл на плотную среду и проращивают.
Общий принцип посевов заключается в том, что образец превращают в такое состояние, когда он может быть серийно разведен, чтобы сделать из него высев или сразу в чашки, или перевести клетки сначала на мембранные фильтры.
В качестве суспензионных жидкостей используют стерильную водопроводную воду, в которую иногда добавляют поверхностно-активные вещества (например, Твин-80, 1капля на 0,5 л), 0,5%-ный раствор NaCl в дистиллированной воде (при выделении психрофильных дрожжей).
Высев на плотные питательные среды из подготовленной суспензии делают пипеткой, внося в каждую чашку по 0,5 мл или по одной капле измеренного объема. Чашек берут всегда не менее трех для каждого разведения, чтобы получить среднее число колоний на одной чашке.
После посева чашки инкубируют 24 ч в обычном положении, чтобы агар адсорбировал жидкость, а за тем перевертывают во избежание попадания на поверхность капель конденсата с крышки.
При инкубировании посевов большое значение имеет поддержание определенной температуры. Преобладающее число видов дрожжей относится к группе мезофильных микроорганизмов с температурными границами роста от 2 – 5 до 30 – 37°С и оптимумом при 26 – 28°С. Среди дрожжей нет истинных термофилов, для роста которых требуются температуры выше 50°С. При выращивании дрожжей при температуре 40 – 45°С необходимо добавлять в среду олеиновую кислоту.( Жвирблянская А.Ю., Исаева В.С.)
Подбор температурных условий при выделении дрожжей зависит от источника выделения и целей исследования. Из теплокровных животных и из различных органов человека и связанных с ним субстратов дрожжи выделяют при 37°С, если хотят найти патогенные формы, и при 28°С в случае поиска сапрофитных видов. Если дрожжи растут при 37°С, то требуется соблюдать осторожность, так как среди них могут быть патогенные – Cryptococcus neoformans или Candida albicans (=Syringospora albicans).
Посевы из материала, где предполагается наличие психрофильных дрожжей, инкубируют в холодильнике при температуре 4 – 5°С.( Коновалов С.А. 1967).
Сроки инкубирования непосредственно зависят от температуры. При 37°С инкубируют не более 4, а в холодильнике не менее 14 сут. Если дрожжи дают визуально заметный рост при 4 – 5°С в течение 7 – 10 дней, то их относят к истинным психрофилам при условии, что выше 20°С они не растут. Температурный оптимум таких дрожжей находится обычно в диапазоне от 10 до 15°С. Психротолерантные дрожжи вырастают при 5°С в течение 2 – 3 недель, а психрофобные при температуре ниже 30°С не растут совсем. В посевах из почвы, инкубируемых при низких температурах, удается учесть в 2 – 3 раза больше дрожжей, чем при 28°С, так как росту дрожжевых колоний при этом не мешают грибы с быстро распространяющимся мицелием. Учет опытов в этих случаях следует производить дважды – через две недели и через месяц.
Стандартные полноценные питательные среды. Эти среды применяют с целью наиболее полного учета и выделения большинства видов дрожжей. Наиболее широко используемой полноценной средой для выращивания дрожжей является солодовое сусло. В его состав входят глюкоза, фруктоза, сахароза, мальтоза, мальтотриоза и мальтотетраоза, а также небольшое количество пентоз – арабиноза, ксилоза и рибоза. Азотные компоненты составляют 6 – 7% сухих веществ (СВ), среди них аммонийного азота 2,18 – 2,44 мг на 100 мл. В сусле имеются аминокислоты, все основные витамины группы В и минеральные вещества, содержание которых зависит от используемой воды.( Бабьева И.П., Голубев В. И.).
Сусло получают с пивоваренных заводов неохмеленное, после фильтрации. Его разводят водопроводной водой до концентрации 6 – 8% СВ.
Для приготовления сусла в лаборатории используют ячменный солод крупного помола с высокой осахаривающей способностью. В 1 л воды вносят 250 г солода и нагревают до 50°С. Через 30 мин постепенно поднимают до 62,5 – 63°С и не снижают до исчезновения реакции на крахмал (йодная проба). Полученное сусло отделяют от дробины путем фильтрации через марлю и вату, разбавляют водой до нужной концентрации, разливают по колбам и стерилизуют при 112°С 30 мин. Если рН ниже 5,5, то сусло подщелачивают 10%-ным раствором соды или едкого кали до получения рН 5,6 – 6,0. Сусло очищают от примесей кизельгуром или отстаиванием в холодильнике с фильтрацией. Для приготовления плотных сред к суслу перед стерилизацией добавляют 2% агара или 20% желатины.( Быков В. А.).
Сусло-агар можно приготовить из сухого солодового экстракта, 20 г порошка растворяют в 400 мл горячей дистиллированной воды, содержащей 12 г агара, и стерилизуют при 121°С 15 мин.
Из синтетических сред наиболее часто для дрожжей используют агар Сабуро, называемый также глюкозо-пептонной средой, со следующим составом(в г на 1 л водопроводной воды): глюкоза 40, пептон 10, агар 20.
Глюкозо-аммонийная среда содержит (в г на 1 л водопроводной воды) следующие вещества: Глюкоза − 20,0; (Nh5) 2SO4 − 5,0; Kh3PO4 − 0,85; K2HPO4 − 0,15; MgSO4 − 0,5; NaCl − 0,1; CaCl2 − 0,1; Агар − 20,0;
Для обогащения факторами роста к этим средам добавляют иногда дрожжевой (0,2%) и мясной (0,3%) экстракты и виноградный сок (3%).
Дифференциальные среды. Их используют при выделении дрожжей из субстратов, сильно загрязненных другими микроорганизмами. Для подавления роста сопутствующих микроорганизмов к указанным выше питательным средам добавляют различные ингибиторы. Рост большинства бактерий и актиномицетов подавляется при низком значении рН среды, поэтому чаще всего среды для выделения дрожжей подкисляют до рН 4,5 путем добавления к ним органических кислот. Для синтетических сред наиболее применима соляная кислота, для сусловых молочная, лимонная или винная. Для подкисления заводского солодового сусла (6 – 8% СВ) обычно требуется 3 – 4 мл/л концентрированной молочной кислоты. Кислоты добавляют в жидкую или расплавленную агаровую среду после стерилизации, непосредственно перед засевом или перед разливкой в чашки Петри. Все дрожжи, кроме Schisosaccharomyces pombe (рН 5,45), растут при рН до 2,5. Если брать 3% агара, то среда застывает при рН 4,8.
Вместо кислот используют также антибиотики широкого спектра действия: стрептомицин (80мг/л или 100 ел/мл), пенициллин (20-100 ед/мл), левомицетин (50 мг/л) и др. Их можно добавлять в среду порознь и в комплексе. Например, против кислотоустойчивых бактерий применяют следующие смеси антибиотиков: актиномицин 2 мг/л +ауреомицин 50 мг/л; пенициллин 60 ед/мл +стрептомицин 100 ед/мл; левомицетин (хлорамфеникол) 20 мг/л +строптомицинсульфат 20 мг/л +хлортетрациклин солянокислый 100 мг/л.
Для отделения сахаромицетов от других дрожжей добавляют 2,5% этилацетата и рН до 4,0 доводят уксусной кислотой. Затем чашки герметизируют. При этих условиях колонии сахаромицетов появляются первыми.
Росту дрожжей на питательных средах при высеве из исходного материала зачастую препятствуют грибы с широко распространяющимися по поверхности субстрата мицелиальными колониями. Они имеют общие с дрожжами потребности в источниках питания, устойчивы к низким значениям рН среды и нечувствительны к действию указанных выше противобактериальных антибиотиков. Для ограничения роста микромицетов в среду добавляют специфические вещества: дифенил (0,005-0,01%), бычью желчь (0,25-0,5%), теллурат калия (0,05-0,15%), пропионат натрия (0,15-0,25%), – или некоторые красители: бром-крезоловый пурпурный (0,0025% или 2,5 мл/л 1% раствора), бенгальский розовый (0,003%), кристаллический фиолетовый (0,001%).
Элективные среды. Их применяют для дрожжей из специфических мест обитания.
Осмофильные дрожжи, обитающие в природе в гнездах диких пчел (в меде), обнаруживаемые в производстве сахара и при порче меда или других продуктов с большим содержанием сахара, выделяют на средах с высоким осмотическим давлением: на медовом и осмофильном агарах.
Состав сред: медовый агар: 70% меда в водопроводной воде и 2% агара; синтетический «медовый» агар: 60 г глюкозы, 0,5 г дрожжевого экстракта, 2,5 г агара, 100мл воды; осмофильный агар: б сироп, содержащий 35 массовых частей сахарозы и 10 частей глюкозы, добавляют агар и стерилизуют 20 мин при 112°. Повторное расплавление не рекомендуется.
При выделении осмофильных дрожжей посевы делают на указанные среды и для сравнения – на обычные. Сахар, мед или сиропы растворяют в воде и фильтруют через мембранные фильтры, которые затем помещают для проращивания на агаровые среды. Почвенные олигонитрофильные дрожжи Lipomyces выделяют на безазотистых средах. Примером такой среды может служить модифицированный агар Эшби (в г 1л дистиллированной воды): Сахароза − 20,0; K2HPO4 − 0,2; Kh3PO4 − 0,1 ; MgSO4·7h3O − 0,2 ; NaCl − 0,2; K2SO4 − 0,1 ; Агар − 20,0.
Для подавления роста бактерий к этой среде добавляют 80 мг/л стрептомицина. Посев производят комочками почвы: навеску в 100 мг распределяют на две чашки Петри, по 50 комочков на каждую. Для равномерного распределения используют трафарет, который подкладывают под чашку. Учет обрастаний производят через 25-30 сут. инкубирования при комнатной температуре. Результат выражают в процентах обрастания комочков почвы молочно-белыми слизистыми колониями липомицетов. (Коновалов С.А.).
Дрожжевые колонии в посевах учитывают следующим образом. Обратную сторону каждой чашки разделяют чернилами на большее или меньшее число частей – от четырех до шестнадцати в зависимости от густоты посева – и просматривают все колонии на каждой площади с объективом 10Ч в просвечивающем микроскопе или с бинокулярной лупой в отраженном свете. Описывают все встречающиеся типы колоний в стандартных терминах. Из них готовят препараты и микроскопируют при больших увеличениях. Этот детальный просмотр колоний при первом посеве очень важен, так как при последующих пересевах некоторые признаки, например спорообразование, иногда исчезают. Рекомендуется сразу же делать фотографии или зарисовки. Колонии разных типов нумеруют и просчитывают отдельно.( Фениксова Р.В.).
Учет производят дважды. В первый срок отмечают с обратной стороны чашки все выросшие и просчитанные колонии, а за тем оставляют чашки еще на несколько дней для наблюдения за возможным появлением колоний медленно растущих дрожжей.
Отдельные изоляты (штаммы) получают путем пересева из индивидуальных колоний в пробирки на те же среды, на которые производили первичный посев, но без добавления специфических ингибиторов.( Бабьева И.П., Голубев В. И.).
Чистой микробной культурой называют популяцию, представляющую собой потомство одного вида микроорганизма. Каждый новый изолят носит название штамма, которому присваивают буквенное или номерное обозначение.
Расами называют производственные штаммы одного вида дрожжей, различающихся между собой по степени проявления физиологической активности.
В генетических исследованиях пользуются так называемыми клонами – чистыми культурами, полученными от одной споры или гаплоидной клетки. (Бабьева И.П., Голубев В. И.).
Существуют прямые и непрямые методы получения чистых культур дрожжей. Первые основаны на выделении одной клетки или споры под непосредственным контролем через микроскоп. Во втором случае используют косвенные приемы для разделения клеток.
Капельный способ Линдера. Суспензию дрожжей разбавляют жидким суслом до концентрации ≈ 100 клеток в 1 мл и стерильным чертежным пером наносят мельчайшие капельки на необезжиренное покровное стекло, простерилизованное фламбированием в пламени газовой горелки. Капельки располагают в определенном порядке, обычно по пять капель в два ряда, т. е. всего 10 капель на стекле. Затем быстро опрокидывают стекло над влажной камерой, которую запечатывают минеральной смазкой. Все капли немедленно просматривают под микроскопом и отмечают те из них, которые содержат по одной единственной клетке. Если все капли содержат по нескольку клеток, то увеличивают разбавление суспензии и процедуру повторяют. После трех – четырехдневного инкубирования, когда отмеченные единичные клетки образуют микроколонии, последние переносят стерильной иглой или полоской стерильной фильтровальной бумаги в жидкую среду и размножают.
Метод Линдера в видоизменении Надсона. Чистое покровное стекло проводят трижды через пламя горелки и края его обводят мастикой (смесь равных частей парафина и вазелинового масла). На центральную часть стекла наносят полоску прозрачной среды ч 10% желатины или 0,5 агара. В теплую и еще не застывшую среду вносят иглой суспензию дрожжей такого разведения, чтобы в каплю попало всего несколько клеток. Стекло помещают во влажную камеру и рассматривают препарат при малом увеличении микроскопа. (Булгаков Н.И.).
Находят ориентиры, которыми могут быть частички взвеси, пузырьки воздуха или дефекты стекла, и вычерчивают карту с расположенными по отношению к ориентирам одиночными клетками дрожжей. Через каждые 10-20 ч препарат повторно исследуют, зарисовывая все изменения. Когда отмеченные клетки разрастаются в микроколонии, покровное стекло перевертывают на предметное и под контролем глаза при малом увеличении микроскопа переносят иглой материал в пробирки. ( Булгаков Н.И.).
Метод Линдера, упрощенный Вучковичем. Видоизменение Вучковичем метода Линдера сводится к тому, что капельки суспензии, содержащие 3-4 клетки дрожжей, снимают петлей, которой предварительно захватывают стерильную среду, и переносят штрихом на поверхность плотной среды. Через некоторое время появляются микроколонии, число которых на одном штрихе должно соответствовать количеству исходных клеток в отмеченной капельке.
Из этих колоний пересевом выделяют чистые культуры. Таким способом можно сразу получить несколько одноклеточных культур за короткое время.
Выделение спор дрожжей при помощи микроманипулятора. К использованию микроманипулятора прибегают главным образом при необходимости изолировать споры из асков, так как вегетативные клетки легко повреждаются при микроманипулировании.
Аски разрывают либо механически прикосновением игл микроманипулятора, либо заранее обрабатывая суспензию препаратом ферментов (например, из пищеварительного тракта виноградной улитки Helix pomatia), из лизирующих клеточную стенку дрожжей.
Для работы с микроманипулятором требуются специальные стеклянные микроиглы и влажные камеры. (Палагина Н. К.).
В эту группу включаются методы, основанные на разделении клеток в питательных средах и использовании специфических биологических особенностей отдельных видов для создания преимущественных условий для их роста.
Метод поверхностного посева на агаровые среды. Посевы производят либо из суспензии пипеткой, либо петлей по принципу «истощающего штриха».
Каплю суспензии, содержащей дрожжевые клетки наносят на поверхность застывшей подсохшей среды в чашке Петри. Стерильным стеклянным шпателем равномерно распределяют каплю по поверхности. Этим же шпателем можно еще засеять 2-3 чашки на случай, если в первой будет очень густой рост колоний. Процессы выделения чистой культуры заканчивается пересевом из отдельной, выросшей изолированно колонии в пробирку. Контролем чистоты выделенной культуры служит однородность клеток под микроскопом и однотипность колоний на чашке при последующем рассеве.
Метод рассева на поверхности агаровых сред можно применять как при работе с уже имеющимися культурами при проверке их чистоты, так и при первичном выделении дрожжей из любого субстрата. С целью повышения возможностей избирательного выделения культур дрожжей определенного вида, для рассева используют селективные среды, а при культивировании создают особые температурные условия. (Попова Т.Е., Попова Е.В.).
Для выделения дрожжей родов Brettanomyces и Lipomyces используют их устойчивость к антибиотику актиноиду, добавление которого в среду в концентрации 100-200 мг/л подавляет рост большинства видов других дрожжей.
Выделение чистых культур баллистоспоровых дрожжей. Баллистоспоровые дрожжи легко получить в чистой культуре, используя их способность отбрасывать споры на значительное расстояние. Если после посева на поверхность агаровой среды налить расплавленный агар в крышку чашки Петри и инкубировать ее в перевернутом положении, то через некоторое время на нижней пластинке появятся колонии в результате прорастания отстрелявшихся баллистоспор.
Поддержание и хранение чистых культур дрожжей
Длительное поддержание чистых культур микроорганизмов необходимо как при проведении научно-исследовательских работ, так и в производстве и при хранении в коллекциях.
Из-за различий биологических свойств видов невозможно использовать с равноценными положительными результатами один общий способ хранения для разных культур дрожжей. Большой опыт по хранению культур микроорганизмов, в том числе и дрожжей, накоплен сотрудниками крупных национальных коллекций, в которых имеется возможность проверять и оценивать разные методы хранения применительно к широкому набору дрожжевых организмов.
Наиболее широко применяемый способ – это поддержание культур путем их периодических пересевов. В последние два десятилетия получили распространение также методы хранения микробных культур под минеральным маслом и лиофильная сушка. Так как эти три метода применяются уже много лет, то имеется возможность сравнительной оценки их пригодности для хранения разных видов дрожжей. Другие, менее широко используемые или недавно разработанные методы можно рекомендовать лишь для проверки с обязательным дублированием культур, которые поддерживаются обычными способами. (Семихатова Н. М., Белова М. Ф., Лозенко Л. Д.).
Периодические пересевы
Обычно культуры поддерживают, пересевая их на агаровых средах в двойной повторности. Одна пробирка, которую после засева совсем не открывают, служит контрольной, а из второй по мере надобности делают отсевы.
Частота пересевов. Сроки пересевов определяют для большинства культур дрожжей скоростью высыхания среды. Она зависит от температуры и влажности помещения, где хранят пробирки. В голландской коллекции*, насчитывающей более 6000 штаммов дрожжей, культуры хранят в специально предназначенных для этих целей, в постоянно проветриваемой комнате, где температура поддерживается зимой 18°С, а летом 20°С. Частота пересевов при этих условиях – каждые 5-7мес или пять раз в два года для основной массы культур и более частые для немногих других: например, ежемесячные для Schizosaccharomices japonicas и каждые две недели для Cyniclomyces (Saccharomycopsis) guttulata.
Промежутки между пересевами можно увеличить за счет более плотного закупоривания пробирок и снижения температуры хранения. Так использование пробирок с завинчивающимися металлическими крышками вместо обычных ватных пробок предохраняет от высушивания, но хуже обеспечивает чистоту сохраняемых культур. Применение вазелинового масла для снижения скорости высыхания культур так же имеет свои недостатки. Поэтому хорошо сделанные ватные пробки(их можно сверху заливать парафином) все же остается лучшим средством закрывания пробирок. Они обеспечивают достаточный газообмен, хорошо предохраняют от микробного загрязнения и легко изготавливаются при помощи специальных машин, которые просты и доступны для любой лаборатории.( Бабьева И.П., Голубев В. И.).
Ватные пробки, однако, не предохраняют культуры от заражения их микофильными клещами (mites). Для профилактики используют следующий прием. Перед посевами или пересевами культур пробку слегка выдвигают из пробирки и наносят на нее каплю раствора содержащего 10г сулемы, 50мл глицерина, 500мл этилового спирта и 450 мл воды. Затем пробку вдвигают в пробирку и несколько раз проворачивают ее, чтобы смочить внутренние стенки пробирки. В раствор можно добавить какой-либо краситель, для контроля за равномерностью смачивания.
Температура. Если хранение ведется при температуре в пределах 15-20°С, то после пересева пробирки сразу же помещают в коллекционное помещение, за исключением тех культур, которые требуют для роста более высокой температуры. К последним относятся, например, такие виды, как Saccaharomyces castellii и Torulopsis lacctis-condensii которые инкубируют при 30°С, а Candida slooffii, Pityrosporum ovale, P. Pachydermatis, Torulopsis bovina, T. Pintolopesii и Saccharomyces telluris – при 37°С психрофильные дрожжи выращивают и хранят при 3-4°С в холодильнике. Это виды: Candida aquatic, C. curiosa, C. salmonicola и все представители рода Leucosporidium. При низкой температуре после появления хорошего роста можно хранить и все другие дрожжи, за исключением психрофобных видов, ассоциированных с теплокровными животными, и некоторых устойчивых к полиеновым антибиотикам мутантов.
Среды. Во многих лабораториях и коллекциях дрожжи поддерживают и хранят на сусло-агаре. Было показано, однако, что на этой сложной среде при длительном хранении происходит изменение физиологических свойств, характерных для вида, за счет адаптации или стабилизации мутантов. В связи с этим для хранения более пригодна среда следующего состава, (в %):
Глюкоза 4 дрожжевая вода
Пептон 0,5 рН 5,8-6,0
Дрожжевую воду готовят, автоклавируя при 121°С 15 мин суспензию дрожжей (200 г на 1 л водопроводной воды) с небольшим количеством яичного белка. После стерилизации еще горячую воду дважды фильтруют через бумажный фильтр..( Бабьева И.П., Голубев В. И.).
Пивоваренные дрожжи лучше поддерживать на сусло-агаре или на среде следующего состава (в %): Сусло − 3; Дрожжевой экстракт − 3; Пептон 5; Глюкоза − 1; Агар − 2.
Лучше растут на сусле, чем на глюкозо-пептонной среде, базидомицетовые дрожжи, близкие к головневым грибам.
Липомицеты поддерживают на среде с солодовым и дрожжевыми экстрактами, на которой эти дрожжи лучше сохраняют спорообразующую способность(в г/л.): Глюкоза − 10; Пептон – 5; Сусловый агар – 3; Дрожжевой экстракт – 3 Агар – 20; Водопроводная вода, л – 1.
В некоторых коллекциях дрожжи поддерживают в жидких средах (сусло с дрожжевым автолизатом, пептоном и глюкозой) с пересевами через 4 мес.
Осмотолерантные дрожжи, например Saccaromyces (Zygosaccaharomyces) rouxii, пересевают на среде с высоким осмотическим давлением, а именно: на сусло-агаре с 50% глюкозы.
Дрожжи родов Brettanomyces и Dekkera сильно подкисляют среду в процессе роста и быстро гибнут, поэтому для их культивирования добавляют в среду 2% СаСО3 и делают пересевы через каждые 2 мес.
Существуют также другие способы хранения чистых культур дрожжевых микроорганизмов.
Хранение под минеральным маслом заливка агаровых культур минеральным маслом с целью задержать высыхание и тем самым увеличить сроки пересевов.
Лиофилизация − процесс высушивания под вакуумом из замороженного состояния.
Методы криогенного хранения − замораживание дрожжей производят при разных режимах, включая температуры от − 10 до − 196°С и различные скорости охлаждения.
Хранение на адсорбентах − в качестве адсорбентов используют почву, песок, коалин, селикагель, вату и фильтровальную бумагу. Этот способ хранения не имеет разработанной стандартной техники.
biofile.ru
Солодово-дрожжевой агар с 40% сахарозы
|
MY 40 AgarСолодово-дрожжевой агар с 40% сахарозы (для осмофильных микроорганизмов) |
M594 |
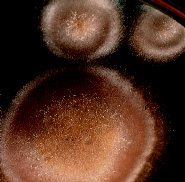
Эту среду используют для определения и выделения осмофильных микроорганизмов из пищевых продуктов.
|
Подсчет осмофильных грибов на среде MY 40 Agar (M594)
|
Состав**:
|
Ингредиенты |
грамм/литр |
|
Солодовый экстракт |
20,00 |
|
Дрожжевой экстракт |
5,00 |
|
Сахароза |
400,00 |
|
Агар-агар |
20,00 |
** Состав выверен и доведен до соответствия необходимым параметрам
Приготовление:
Размешать 44,5 г порошка в 100 мл дистиллированной воды. Подогреть до кипения с помешиванием для полного растворения частиц. Стерилизовать автоклавированием при 1,1 атм (121°С) в течение 15 мин. НЕ ДОПУСКАТЬ ПЕРЕГРЕВАНИЯ СРЕДЫ.
Принцип и оценка результата:
Эта среда приводится по прописи АРНА (1) и используется для определения и выделения из пищевых продуктов осмофильных микроорганизмов, в частности, дрожжевых грибов, которые часто встречаются в обстановке производства пищевых продуктов. Они могут расти в высококонцентрированных растворах сахара (2), часто контаминируют мед, шоколад, варенье, патоку, кукурузные сиропы, фруктовые соки и подобные им пищевые продукты (3, 4). Необходимо различать осмофильные и осмотолерантные дрожжевые грибы (5). Почти все известные осмофильные дрожжи относятся к видам сахаромицетов (например, Sacharomyces rouxii var polymorphus, Sacharomyces mellis и др.). Установлено, что осмофильные дрожжи лучше выделять на средах, которые по составу напоминают исследуемые продукты или содержат высокие концентрации сахара (2). Аббревиатура «MY 40» означает, что в состав среды входят солодовый и дрожжевой экстракты, а также 40% сахарозы, что удовлетворяет вышеуказанные потребности (6). Экстракты обеспечивают присутствие в среде азотистых веществ, аминокислот, витаминов, микроэлементов, необходимых для роста осмофильных дрожжей.
Контроль качества:
Внешний вид порошка:
Гомогенный сыпучий беловатый или желтый порошок.
Плотность готовой среды:
Образуется среда, соответствующая по плотности 2,0%-ному агаровому гелю.
Цвет и прозрачность готовой среды:
Среда имеет янтарную окраску, слегка опалесцирует, если в чашках Петри формируется гель.
Культуральные свойства:
Ростовые характеристики референс-штаммов в течение 1 недели при 30°С.
|
Штаммы микроорганизмов (АТСС) |
Рост |
|
Aspergillus niger (16404) |
Хороший или обильный |
|
Mucor racemosus (22365) |
Хороший или обильный |
|
Penicillium notatum (10108) |
Хороший или обильный |
|
Sacharomyces rouxii |
Хороший или обильный |
Условия и сроки хранения:
Порошок хранить при температуре ниже +25°С. Использовать до даты, указанной на этикетке. Готовую среду хранить при температуре +2…8°С.
www.himedialabs.ru
Получение чистой культуры дрожжей
В зависимости от программы исследований выбирают тот или иной метод отбора образцов, позволяющий либо только обнаружить и количественно учесть дрожжевые организмы в анализируемом субстрате, либо обнаружить для накопления их биомассы. В разных областях научных исследований и каждой отрасли промышленности имеются свои указания относительно деталей правильного отбора проб для микробиологического анализа.
Поверхность твердого тела. Ее исследуют путем получения смыва, отпечатка или соскоба.
Смыв производят стерильной водой непосредственно с объекта, помещая его в сосуд или же при больших размерах объекта пользуясь ватными или марлевыми тампонами. Такие тампоны затем опускают в суспензионную жидкость, встряхивают и делают высев. Недостатки этого метода заключаются в том, что его, во первых, трудно стандартизовать (разные люди прикладывают разные усилия при смыве ) и во вторых, вата активно сорбирует клетки микроорганизмов и суспензия получается обедненной. Для количественного учета эта техника непригодна. Несмотря на указанные недостатки ,различные методы смыва остаются на более распространенными в области медицинской и санитарной микробиологии, а также при изучении эпифитной флоры зеленых растений. В последнем случае используют непосредственный смыв без тампонов путем нанесения целых листьев или их частей в колбы с водой. При сравнительных исследованиях из листа вырезают пластинки стандартной площади, чтобы можно было сделать пересчет числа микроорганизмов на 1см 2 . листья или вырезанные из них пластинки встряхивают в колбе с водой 10 минут на качалке, а затем делают.
Растирание материала, которое иногда рекомендуют, не всегда желательно, так как при этом освобождаются токсические вещества, фитонциды, которые могут оказать губительное действие на микробные клетки.
Метод смыва с поверхностей применяют при исследовании таких объектов, как плоды и овощи, зерно и сметана, мясо и шкуры и тому подобное, а также с оборудования. Соскоб производят стерильным скальпелем непосредственно в сосуд со стерильной водой. Суспензию перед посевом либо встряхивают 10 минут, либо обрабатывают 5 минут на микроразмельчителе тканей. Отпечатки приготовляют прямыми или опосредованными методами.
Прямые методы основаны на снятии дрожжевых клеток с исследуемой поверхности различными прозрачными адгезивными материалами: Коллодиевой пленкой бесцветным лаком, липкой целлофановой лентой, полиэтиленовой пленкой, смазанной клеящим веществом. Полученные отпечатки просматривают под микроскопом опуская пленки в капли воды или лактофенола на предметном стекле.
Липкой лентой можно снимать и предварительно нанесенную на поверхность объекта тонкую агаровую пленку. Полоску ленты с агаром и прикрепившимися к нему дрожжевыми клетками, рассматривают затем под микроскопом без проращивания. Методы получения отпечатков имеют некоторые общие недостатки: далеко не все клетки снимаются с исследуемой поверхности; при густой обсемененности клетки могут располагаться слишком близко друг от друга и их трудно учитывать. При получении отпечатка с последующим проращиванием исследуемый объект прижимают к поверхности плотной питательной среды, а затем его удаляют, и чашки со средой ставят в термостат. Таким образом удается хорошо наблюдать плотность заселения и характер распределения дрожжей на поверхности листовой пластинки. Если объект большого размера, то поступают наоборот: к нему прижимают приготовленную среду, пользуясь методом агаровой колбаски. Колбаски делают из разных питательных агаров, запечатывая их стерильно в пергаментную обертку. Срезая последовательно круглые ломтики, их 4 размещают в стерильные чашки Петри и проращивают во влажной камере.
Отпечатки можно получать с помощью мягких пластичных материалов, таких как бархат, замша, вельвет из которых делают круглые подушки - репликаторы. Лучше всего использовать - бархат велюр, белый или бледно желтый (другие краски могут быть токсичны).Бархат первоначально кипятят, режут круглые куски и приклеивают их к алюминиевым дискам такого размера чтобы они помещались в чашку Петри.
Стерилизую завернутыми в бумагу сухим жаром при 160оС 1 ч. Перед использованием поверхность бархата смачивают жидкой питательной средой и прикладывают его к исследуемому объекту на несколько секунд. Затем не сдвигая! Осторожно отнимаю и переносят в чашку Петри. Отпечатки делают на серии чашек с одной или разными средами. После употребления репликаторы стерилизуют в сосудах с водой автоклавированием 20 мин при 120оС, подсушивают и расправляют бархат шпателем. Особенно удобно пользоваться мягкими репликаторами при работе с неровными и шероховатыми поверхностями.
Сыпучие и плотные субстраты. Их берут для анализа в стерильные пергаментные пакеты. Влажные пробы отбирают в стерильные стеклянные банки или новые полиэтиленовые пакеты. Отбор проб ила со дна водоемов производят статометром, или дночерпателем. В других случаях пробы можно брать специальной ложкой, ножем или шпателем, которые предварительно протирают спиртом и обжигают. При сборе образцов почв для экологического исследования соблюдают специальные правила, гарантирующие репрезентативной выборки.
Прозрачные жидкости и взвеси. Присутствие дрожжей в них можно установить непосредственно под микроскопом или после концентрирования на центрифугах при частоте вращения 2000 об/мин в течении 15-20 мин.
Пробу воды и жидкостей отбирают в стерильные сосуды. Воду из природных водоемов берут специальными приборами-батометрами. Из них воду фильтруют через мембранные фильтры с порами диаметром 1,2 мкм. Далее фильтры либо помещают на поверхность питательных сред для проращивания клеток дрожжей, либо окрашивают и наблюдают под микроскопом. Можно брать два фильтра: один для проращивания и окраски, а другой (нижний) для контроля на пропускание.
Масла и эмульсии, включая сливочное масло и мороженое, можно также исследовать методом мембранных фильтров после обработки их эмульгаторами. Жидкости и взвеси необходимо анализировать вскоре после отбора проб, а при невозможности этого хранить в холодильнике не более 1-2 сут, так как далее первоначальное количество дрожжей в них может существенно измениться.
Воздух. Методы анализа воздуха основаны либо на осаждении аэрозолей, либо на фильтрации его через жидкости или твердые фильтры.
Метод Коха основывается на свободном оседании микробных аэрозолей на поверхность питательной среды под влиянием гравитационных сил. Чашки со средой оставляют открытыми на 5-15 мин, а затем закрывают и помещают в термостат. Этот метод используют для обнаружения дрожжей в воздухе закрытых помещений при кратковременной экспозиции чашек. В открытых местах его использованию мешают горизонтальные потоки воздуха.
Все другие методы определения микроорганизмов в воздухе основан на принудительном его токе, который создается разными способами.
Для санитарно-микологического контроля окружающей среды на предприятиях по производству белково-витаминных препаратов и кормовых дрожжей количественный учет дрожжей – продуцентов рода Сandida рекомендуется проводить щелевым методом на сусло-агаре и МБС – метабисульфитном агаре (МПА + 0,2% метабисульфита натрия ) с добавлением биомицина в количестве 100000 ед/л. Рост продолжается 48ч при 37°.
Для фильтрации воздуха через жидкости используют прибор Киктенко, основанный на осаждении микробных клеток в улавливающей жидкости, которую затем переносят по 0,1 – 0,3 мл на плотную среду и проращивают.
Общий принцип посевов заключается в том, что образец превращают в такое состояние, когда он может быть серийно разведен, чтобы сделать из него высев или сразу в чашки, или перевести клетки сначала на мембранные фильтры.
В качестве суспензионных жидкостей используют стерильную водопроводную воду, в которую иногда добавляют поверхностно-активные вещества (например, Твин-80, 1капля на 0,5 л), 0,5%-ный раствор NaCl в дистиллированной воде (при выделении психрофильных дрожжей).
Высев на плотные питательные среды из подготовленной суспензии делают пипеткой, внося в каждую чашку по 0,5 мл или по одной капле измеренного объема. Чашек берут всегда не менее трех для каждого разведения, чтобы получить среднее число колоний на одной чашке.
После посева чашки инкубируют 24 ч в обычном положении, чтобы агар адсорбировал жидкость, а за тем перевертывают во избежание попадания на поверхность капель конденсата с крышки.
При инкубировании посевов большое значение имеет поддержание определенной температуры. Преобладающее число видов дрожжей относится к группе мезофильных микроорганизмов с температурными границами роста от 2 – 5 до 30 – 37°С и оптимумом при 26 – 28°С. Среди дрожжей нет истинных термофилов, для роста которых требуются температуры выше 50°С. При выращивании дрожжей при температуре 40 – 45°С необходимо добавлять в среду олеиновую кислоту.
Подбор температурных условий при выделении дрожжей зависит от источника выделения и целей исследования. Из теплокровных животных и из различных органов человека и связанных с ним субстратов дрожжи выделяют при 37°С, если хотят найти патогенные формы, и при 28°С в случае поиска сапрофитных видов. Если дрожжи растут при 37°С, то требуется соблюдать осторожность, так как среди них могут быть патогенные – Cryptococcus neoformans или Candida albicans (Syringospora albicans).
Посевы из материала, где предполагается наличие психрофильных дрожжей, инкубируют в холодильнике при температуре 4 – 5°С.
Сроки инкубирования непосредственно зависят от температуры. При 37°С инкубируют не более 4, а в холодильнике не менее 14 сут. Если дрожжи дают визуально заметный рост при 4 – 5°С в течение 7 – 10 дней, то их относят к истинным психрофилам при условии, что выше 20°С они не растут. Температурный оптимум таких дрожжей находится обычно в диапазоне от 10 до 15°С. Психротолерантные дрожжи вырастают при 5°С в течение 2 – 3 недель, а психрофобные при температуре ниже 30°С не растут совсем. В посевах из почвы, инкубируемых при низких температурах, удается учесть в 2 – 3 раза больше дрожжей, чем при 28°С, так как росту дрожжевых колоний при этом не мешают грибы с быстро распространяющимся мицелием. Учет опытов в этих случаях следует производить дважды – через две недели и через месяц.
Стандартные полноценные питательные среды. Эти среды применяют с целью наиболее полного учета и выделения большинства видов дрожжей. Наиболее широко используемой полноценной средой для выращивания дрожжей является солодовое сусло. В его состав входят глюкоза, фруктоза, сахароза, мальтоза, мальтотриоза и мальтотетраоза, а также небольшое количество пентоз – арабиноза, ксилоза и рибоза. Азотные компоненты составляют 6 – 7% сухих веществ (СВ), среди них аммонийного азота 2,18 – 2,44 мг на 100 мл. В сусле имеются аминокислоты, все основные витамины группы В и минеральные вещества, содержание которых зависит от используемой воды.
Сусло получают с пивоваренных заводов неохмеленное, после фильтрации. Его разводят водопроводной водой до концентрации 6 – 8% СВ.
Для приготовления сусла в лаборатории используют ячменный солод крупного помола с высокой осахаривающей способностью. В 1 л воды вносят 250 г солода и нагревают до 50°С. Через 30 мин постепенно поднимают до 62,5 – 63°С и не снижают до исчезновения реакции на крахмал (йодная проба). Полученное сусло отделяют от дробины путем фильтрации через марлю и вату, разбавляют водой до нужной концентрации, разливают по колбам и стерилизуют при 112°С 30 мин. Если рН ниже 5,5, то сусло подщелачивают 10%-ным раствором соды или едкого кали до получения рН 5,6 – 6,0. Сусло очищают от примесей кизельгуром или отстаиванием в холодильнике с фильтрацией. Для приготовления плотных сред к суслу перед стерилизацией добавляют 2% агара или 20% желатины.
Сусло-агар можно приготовить из сухого солодового экстракта, 20 г порошка растворяют в 400 мл горячей дистиллированной воды, содержащей 12 г агара, и стерилизуют при 121°С 15 мин.
Из синтетических сред наиболее часто для дрожжей используют агар Сабуро, называемый также глюкозо-пептонной средой, со следующим составом(в г на 1 л водопроводной воды): глюкоза 40, пептон 10, агар 20.
Глюкозо-аммонийная среда содержит (в г на 1 л водопроводной воды) следующие вещества: Глюкоза − 20,0; (Nh5) 2SO4 − 5,0; Kh3PO4 − 0,85; K2HPO4 − 0,15; MgSO4 − 0,5; NaCl − 0,1; CaCl2 − 0,1; Агар − 20,0;
Для обогащения факторами роста к этим средам добавляют иногда дрожжевой (0,2%) и мясной (0,3%) экстракты и виноградный сок (3%).
Дифференциальные среды. Их используют при выделении дрожжей из субстратов, сильно загрязненных другими микроорганизмами. Для подавления роста сопутствующих микроорганизмов к указанным выше питательным средам добавляют различные ингибиторы. Рост большинства бактерий и актиномицетов подавляется при низком значении рН среды, поэтому чаще всего среды для выделения дрожжей подкисляют до рН 4,5 путем добавления к ним органических кислот. Для синтетических сред наиболее применима соляная кислота, для сусловых молочная, лимонная или винная. Для подкисления заводского солодового сусла (6 – 8% СВ) обычно требуется 3 – 4 мл/л концентрированной молочной кислоты. Кислоты добавляют в жидкую или расплавленную агаровую среду после стерилизации, непосредственно перед засевом или перед разливкой в чашки Петри. Все дрожжи, кроме Schisosaccharomyces pombe (рН 5,45), растут при рН до 2,5. Если брать 3% агара, то среда застывает при рН 4,8.
Вместо кислот используют также антибиотики широкого спектра действия: стрептомицин (80мг/л или 100 ел/мл), пенициллин (20-100 ед/мл), левомицетин (50 мг/л) и др. Их можно добавлять в среду порознь и в комплексе. Например, против кислотоустойчивых бактерий применяют следующие смеси антибиотиков: актиномицин 2 мг/л +ауреомицин 50 мг/л; пенициллин 60 ед/мл +стрептомицин 100 ед/мл; левомицетин (хлорамфеникол) 20 мг/л +строптомицинсульфат 20 мг/л +хлортетрациклин солянокислый 100 мг/л.
Для отделения сахаромицетов от других дрожжей добавляют 2,5% этилацетата и рН до 4,0 доводят уксусной кислотой. Затем чашки герметизируют. При этих условиях колонии сахаромицетов появляются первыми.
Росту дрожжей на питательных средах при высеве из исходного материала зачастую препятствуют грибы с широко распространяющимися по поверхности субстрата мицелиальными колониями. Они имеют общие с дрожжами потребности в источниках питания, устойчивы к низким значениям рН среды и нечувствительны к действию указанных выше противобактериальных антибиотиков. Для ограничения роста микромицетов в среду добавляют специфические вещества: дифенил (0,005-0,01%), бычью желчь (0,25-0,5%), теллурат калия (0,05-0,15%), пропионат натрия (0,15-0,25%), – или некоторые красители: бром-крезоловый пурпурный (0,0025% или 2,5 мл/л 1% раствора), бенгальский розовый (0,003%), кристаллический фиолетовый (0,001%).
Элективные среды. Их применяют для дрожжей из специфических мест обитания.
Осмофильные дрожжи, обитающие в природе в гнездах диких пчел (в меде), обнаруживаемые в производстве сахара и при порче меда или других продуктов с большим содержанием сахара, выделяют на средах с высоким осмотическим давлением: на медовом и осмофильном агарах.
Состав сред: медовый агар: 70% меда в водопроводной воде и 2% агара; синтетический «медовый» агар: 60 г глюкозы, 0,5 г дрожжевого экстракта, 2,5 г агара, 100мл воды; осмофильный агар: б сироп, содержащий 35 массовых частей сахарозы и 10 частей глюкозы, добавляют агар и стерилизуют 20 мин при 112°. Повторное расплавление не рекомендуется.
При выделении осмофильных дрожжей посевы делают на указанные среды и для сравнения – на обычные. Сахар, мед или сиропы растворяют в воде и фильтруют через мембранные фильтры, которые затем помещают для проращивания на агаровые среды. (Жвирблянская А.Ю., Исаева В.С). Почвенные олигонитрофильные дрожжи Lipomyces выделяют на безазотистых средах. Примером такой среды может служить модифицированный агар Эшби (в г 1л дистиллированной воды) : Сахароза − 20,0; K2HPO4 − 0,2; Kh3PO4 − 0,1 ; MgSO4·7h3O − 0,2 ; NaCl − 0,2; K2SO4 − 0,1 ; Агар − 20,0.
Для подавления роста бактерий к этой среде добавляют 80 мг/л стрептомицина. Посев производят комочками почвы: навеску в 100 мг распределяют на две чашки Петри, по 50 комочков на каждую. Для равномерного распределения используют трафарет, который подкладывают под чашку. Учет обрастаний производят через 25-30 сут. инкубирования при комнатной температуре. Результат выражают в процентах обрастания комочков почвы молочно-белыми слизистыми колониями липомицетов. (Коновалов С.А.).
Дрожжевые колонии в посевах учитывают следующим образом. Обратную сторону каждой чашки разделяют чернилами на большее или меньшее число частей – от четырех до шестнадцати в зависимости от густоты посева – и просматривают все колонии на каждой площади с объективом 10× в просвечивающем микроскопе или с бинокулярной лупой в отраженном свете. Описывают все встречающиеся типы колоний в стандартных терминах. Из них готовят препараты и микроскопируют при больших увеличениях. Этот детальный просмотр колоний при первом посеве очень важен, так как при последующих пересевах некоторые признаки, например спорообразование, иногда исчезают. Рекомендуется сразу же делать фотографии или зарисовки. Колонии разных типов нумеруют и просчитывают отдельно.
 Колония жрожжей под микроскопом. Фото: Tess Watson
Колония жрожжей под микроскопом. Фото: Tess Watson
Учет производят дважды. В первый срок отмечают с обратной стороны чашки все выросшие и просчитанные колонии, а за тем оставляют чашки еще на несколько дней для наблюдения за возможным появлением колоний медленно растущих дрожжей. Отдельные изоляты (штаммы) получают путем пересева из индивидуальных колоний в пробирки на те же среды, на которые производили первичный посев, но без добавления специфических ингибиторов.
Чистой микробной культурой называют популяцию, представляющую собой потомство одного вида микроорганизма. Каждый новый изолят носит название штамма, которому присваивают буквенное или номерное обозначение.
Расами называют производственные штаммы одного вида дрожжей, различающихся между собой по степени проявления физиологической активности.
В генетических исследованиях пользуются так называемыми клонами – чистыми культурами, полученными от одной споры или гаплоидной клетки. (Бабьева И.П., Голубев В. И.).
Существуют прямые и непрямые методы получения чистых культур дрожжей. Первые основаны на выделении одной клетки или споры под непосредственным контролем через микроскоп. Во втором случае используют косвенные приемы для разделения клеток.
Капельный способ Линдера. Суспензию дрожжей разбавляют жидким суслом до концентрации ≈ 100 клеток в 1 мл и стерильным чертежным пером наносят мельчайшие капельки на необезжиренное покровное стекло, простерилизованное фламбированием в пламени газовой горелки. Капельки располагают в определенном порядке, обычно по пять капель в два ряда, т. е. всего 10 капель на стекле. Затем быстро опрокидывают стекло над влажной камерой, которую запечатывают минеральной смазкой. Все капли немедленно просматривают под микроскопом и отмечают те из них, которые содержат по одной единственной клетке. Если все капли содержат по нескольку клеток, то увеличивают разбавление суспензии и процедуру повторяют. После трех – четырехдневного инкубирования, когда отмеченные единичные клетки образуют микроколонии, последние переносят стерильной иглой или полоской стерильной фильтровальной бумаги в жидкую среду и размножают.
Метод Линдера в видоизменении Надсона. Чистое покровное стекло проводят трижды через пламя горелки и края его обводят мастикой (смесь равных частей парафина и вазелинового масла). На центральную часть стекла наносят полоску прозрачной среды ч 10% желатины или 0,5 агара. В теплую и еще не застывшую среду вносят иглой суспензию дрожжей такого разведения, чтобы в каплю попало всего несколько клеток. Стекло помещают во влажную камеру и рассматривают препарат при малом увеличении микроскопа.
Находят ориентиры, которыми могут быть частички взвеси, пузырьки воздуха или дефекты стекла, и вычерчивают карту с расположенными по отношению к ориентирам одиночными клетками дрожжей. Через каждые 10-20 ч препарат повторно исследуют, зарисовывая все изменения. Когда отмеченные клетки разрастаются в микроколонии, покровное стекло перевертывают на предметное и под контролем глаза при малом увеличении микроскопа переносят иглой материал в пробирки.
Метод Линдера, упрощенный Вучковичем. Видоизменение Вучковичем метода Линдера сводится к тому, что капельки суспензии, содержащие 3-4 клетки дрожжей, снимают петлей, которой предварительно захватывают стерильную среду, и переносят штрихом на поверхность плотной среды. Через некоторое время появляются микроколонии, число которых на одном штрихе должно соответствовать количеству исходных клеток в отмеченной капельке.
Из этих колоний пересевом выделяют чистые культуры. Таким способом можно сразу получить несколько одноклеточных культур за короткое время.
Выделение спор дрожжей при помощи микроманипулятора. К использованию микроманипулятора прибегают главным образом при необходимости изолировать споры из асков, так как вегетативные клетки легко повреждаются при микроманипулировании.
Аски разрывают либо механически прикосновением игл микроманипулятора, либо заранее обрабатывая суспензию препаратом ферментов (например, из пищеварительного тракта виноградной улитки Helix pomatia), из лизирующих клеточную стенку дрожжей. Для работы с микроманипулятором требуются специальные стеклянные микроиглы и влажные камеры.
В эту группу включаются методы, основанные на разделении клеток в питательных средах и использовании специфических биологических особенностей отдельных видов для создания преимущественных условий для их роста.
Метод поверхностного посева на агаровые среды. Посевы производят либо из суспензии пипеткой, либо петлей по принципу «истощающего штриха».
Каплю суспензии, содержащей дрожжевые клетки наносят на поверхность застывшей подсохшей среды в чашке Петри. Стерильным стеклянным шпателем равномерно распределяют каплю по поверхности. Этим же шпателем можно еще засеять 2-3 чашки на случай, если в первой будет очень густой рост колоний. Процессы выделения чистой культуры заканчивается пересевом из отдельной, выросшей изолированно колонии в пробирку. Контролем чистоты выделенной культуры служит однородность клеток под микроскопом и однотипность колоний на чашке при последующем рассеве.
Метод рассева на поверхности агаровых сред можно применять как при работе с уже имеющимися культурами при проверке их чистоты, так и при первичном выделении дрожжей из любого субстрата. С целью повышения возможностей избирательного выделения культур дрожжей определенного вида, для рассева используют селективные среды, а при культивировании создают особые температурные условия.
Для выделения дрожжей родов Brettanomyces и Lipomyces используют их устойчивость к антибиотику актиноиду, добавление которого в среду в концентрации 100-200 мг/л подавляет рост большинства видов других дрожжей.
Выделение чистых культур баллистоспоровых дрожжей. Баллистоспоровые дрожжи легко получить в чистой культуре, используя их способность отбрасывать споры на значительное расстояние. Если после посева на поверхность агаровой среды налить расплавленный агар в крышку чашки Петри и инкубировать ее в перевернутом положении, то через некоторое время на нижней пластинке появятся колонии в результате прорастания отстрелявшихся баллистоспор.
biofile.ru
НПО "Альтернатива" - 5.5. Факторы инактивации дрожжей
Для замедления роста или инактивации и гибели дрожжей используют самые разные физические и химические факторы (и средства). Их эффективность в значительной степени зависит от дозы (концентрации) и длительности воздействия. Кроме того, взаимодействие факторов между собой может определять их эффективность. Все они в настоящее время имеют большое практическое значение.
5.5.1. Нагревание
Высокие температуры инактивируют дрожжевые клетки. При температуре выше 55°С дрожжи обычно погибают в течение нескольких минут. В отличие от бактериальных эндоспор, аскоспоры и базидиоспоры дрожжей лишь ненамного устойчивее к теплу, чем вегетативные клетки. Время десятикратного уменьшения численности (показатель D) при 55°С составляет примерно 5-10 мин, а при 65°С – менее 1 мин. При увеличении температуры на 4-5°С скорость гибели возрастает в десять раз, то есть показатель z равняется 4-5°С (это усредненные значения). Кроме того, на скорость инактивации значительное влияние оказывает состав пищевого продукта. Например, показатели D для Pichia anomala во фруктовых соках составляют около 6 мин при рН 3,95, 3 мин – при рН3,0 и 2 мин – при рН 2,62. Термостойкость клеток снижается по мере увеличения кислотности и возрастает с уменьшением αω. Следовательно, фруктовые соки (рН около 3,5) можно консервировать путем пастеризации, однако ее температура может оказаться недостаточной для консервирования джемов с таким же pН, но содержащих более 55% сахара.
5.5.2. Замораживание
Замораживание не вызывает немедленной гибели дрожжевых клеток, хотя количество выживших клеток в замороженном состоянии со временем уменьшается. Степень и скорость гибели клеток при замораживании зависит от ряда факторов – температуры замораживания, скорости снижения температуры, времени пребывания в замороженном состоянии и условий размораживания. В целом, чем выше скорость замораживания и размораживания и ниже температура хранения в замороженном состоянии, тем выше процент выживших клеток. Это происходит вследствие образования микрокристаллов льда, которые уменьшают повреждение клеток при замораживании. В таких условиях время, в течение которого клеточные мембраны подвергаются разрушительному воздействию возрастающего осмотического давления, оказывается меньше. Отсюда следует чисто практический вывод: культурные штаммы дрожжей можно хранить при -80°С длительное время, причем наилучший способ сохранить штаммы – провести их быструю и глубокую заморозку при температуре паров жидкого азота (-196°С).
5.5.3. Обезвоживание
Снижение активности воды ниже значений, допускающих рост дрожжей, может быть достигнуто различными способами. Один из старейших методов консервирования пищевых продуктов – сушка – все еще успешно применяется для ингибирования роста дрожжей во фруктах и овощах (например, изюм, орехи и бобы). Высокие концентрации сахара (50-60%) или соли (5-10%) также приводят к связыванию свободной воды и предотвращают размножение дрожжей (например, в джемах, сиропах, ветчине и соевом соусе). Некоторые ксеротолерантные (осмофильные) дрожжи, например Zygosaccharomyces spp., способны к медленному росту, особенно если влага абсорбируется на поверхности продуктов.
В сухих и концентрированных пищевых продуктах активность воды ниже 0,70, а у огромного числа разных пищевых продуктов, например, у сыров, колбас и хлебобулочных изделий, она находится в интервале от 0,85 до 0,95. Такие продукты называют продуктами умеренной влажности, и для сохранения их качества применяются другие методы консервирования (охлаждение, вакуумная упаковка, упаковка в модифицированной газовой среде, внесение консервантов), а также их сочетание.
5.5.4. Облучение
Различного рода ионизирующее излучение (электронные лучи, рентгеновские лучи, гамма-излучение изотопами 60Со) характеризуется высокой энергией и вызывает интенсивную гибель клеток. Облучение пищевых продуктов давно признано одним из эффективных методов консервирования. Многочисленные исследования и накопленный производственный опыт позволили четко установить его недостатки и преимущества. Следует отметить, что до сих пор наблюдается определенное неприятие потребителем облученных пищевых продуктов, хотя применение этого метода одобрено во многих странах.
Никакая другая технология консервирования не исследовалась так тщательно, как облучение. Существует большое количество научно-технической литературы, посвященной сто применению и биологическим последствиям. Мы приводим лишь немногие из этих данных, относящиеся к дрожжам. Результаты исследования радиационной стойкости некоторых видов дрожжей приведены в табл. 5.8. Радиационная стойкость дрожжей выше, чем у большинства вегетативных бактерий. Значение десятикратного снижения численности дрожжей находится в интервале 0,1-0,5 кГр, а доза облучения около 5 кГр уменьшает их количество на 10 логарифмических циклов. Следует отметить, что кривые выживания часто имеют «плечи», что значительно затрудняет расчет дозы облучения. Пo всей видимости, некоторые дрожжи, например, Trichosporon spp. или, по крайней мере, некоторые штаммы этих видов, обладают еще более высокой радиационной стойкостью.
При промышленном применении гамма-излучение в относительно слабых дозах (1-3 кГр) позволяет значительно снизить дрожжевую контаминацию портящихся фруктов и увеличить срок их хранения. Особенно перспективным является применение облучения для увеличения срока хранения мягких ягод (например, малины и земляники), которые теряют качество и внешний вид при тепловом и холодильном консервировании.
Таблица 5.8. Радиационная стойкость некоторых дрожжей (по данным [4])
| Виды дрожжей* | Облучаемая среда | Доза облучения, кГр** |
| Sporidioholus pararoseus | Питательный бульон | 5 |
| Issatchenkia orientalis | Фосфатный буфер | 5,5 |
| Debaryomyces hansenii | Виноградный сок | 7,5 |
| Cryptococcus albidus | Виноградный сок | 10 |
| Torulaspora delbrueckii | Виноградный сок | 15 |
| Saccharomyces cerevisiae | Виноградный сок | 18 |
| Trichosporon pullulans | Фосфатный буфер | 20 |
* Исходное количество клеток – 106-107/мл.
**Доза, необходимая для предотвращения роста в течение 15 сут.
5.5.5. Консерванты
Мягкие химические консерванты на основе органических кислот (сорбиновой, бензойной, пропионовой и их солей) в концентрациях, разрешенных для применения в пищевых продуктах, подавляют рост дрожжей. Эффективность этих консервантов максимальна при низких значениях рН. Сорбат калия более эффективен для дрожжей, чем бензоат натрия. Некоторые виды дрожжей, особенно Zygosaccharomyces bailii, устойчивы к действию консервантов и способны не только адаптироваться к их высоким концентрациям, но и преодолевать их ингибирующее действие, метаболизируя и разлагая консерванты. Для временной консервации мякоти плодов может использоваться сернистый газ. При брожении вина в виноградное сусло для инактивации диких дрожжей (определенных видов Pichia и Candida) добавляют сульфит, поскольку винные дрожжи S. cerevisiae менее чувствительны кSO2).
5.5.6. Комбинированные системы консервирования
Для более мягкой обработки и сохранения пищевой ценности и органолептического качества пищевых продуктов при обеспечении требуемого уровня безопасности методы и средства консервации могут применяться комбинированно. Одновременное применение нескольких консервирующих факторов многие называют «барьерной технологией» и поясняют это одновременным созданием нескольких «барьеров», которые микроорганизмы преодолеть не способны. Действительно, эта аналогия вполне адекватна, так как в данном случае речь идет об одновременном действии нескольких «барьеров», которые синергично взаимодействуют. На этом подходе основаны разработки новых продуктов и методов консервирования, например, минимальная тепловая и холодильная обработка продуктов, упаковка в модифицированной газовой среде, и создание продуктов умеренной влажности.
При минимальной тепловой обработке пищевые продукты подвергаются более мягкому температурному воздействию, содержат меньше кислот, соли и сахара, а также значительно меньше консервантов (сульфитов, нитритов, сорбиновой и бензойной кислот), однако для таких консервов обычно применяют холодильное хранение [7]. Сочетание консервирующих факторов призвано защитить продукт от роста патогенных бактерий, однако оно не всегда препятствует развитию ДВПП. Типичным примером являются готовые к употреблению фрукты и овощи, обработка которых включает предварительную очистку, удаление кожуры или нарезку на доли, мойку, дезинфекцию и упаковку. При этом для контроля ферментативного потемнения и снижения количества дрожжей, плесеней и бактерии используют бланширование [5].
Пищевые продукты умеренной влажности, как правило, характеризуются αωниже 0,90, что в сочетании с низким рН, пастеризацией или охлаждением (холодильным хранением) делает их пригодными для продолжительного хранения. Кроме мясных продуктов и сыров примером продуктов умеренной влажности могут служить фруктовые пресервы. Целые фрукты, их половники, ломтики или фруктовое пюре можно консервировать, применяя бланширование и регулирование αωв диапазоне 0,91-0,98 с использованием сахара. Значения рН большинства фруктов находится в интервале 3,1-3,5, и при необходимости они могут быть снижены путем добавления лимонной кислоты. Кроме того, могут быть использованы также сульфиты и сорбаты. В таких условиях потенциальными микроорганизмами, которые могут вызвать порчу, являются дрожжи (особенно осмофильные).
Для сохранения свежих и минимально обработанных продуктов часто применяют упаковку с использованием регулируемой газовой среды (MAP,РГС). В случае мясных продуктов снижение содержания кислорода внутри упаковки достигается применением вакуума, тогда как собственное дыхание свежих фруктов и овощей модифицирует газовую среду внутри упаковки после их помещения в полупроницаемую или термоусадочную пленку. Содержание кислорода при этом снижается до 3-5%, а концентрация СО2 возрастает до 5-10%. В таких условиях рост аэробных бактерий и плесеней значительно снижается, однако отмечается замедленный рост дрожжей и молочнокислых бактерий, даже если продукт упакован с использованием модифицированной газовой среды и хранится в условиях охлаждения.
5.5.7. Повреждение и восстановление дрожжевых клеток
Важным аспектом применения комбинированных методов консервирования является возможность выживания микроорганизмов. Сублетальная температура не всегда приводит к гибели дрожжевых клеток, а только нарушает их клеточную структуру и/или метаболизм. При такой обработке возможно повреждение клеточных мембран, что вызывает потери компонентов клеток и нарушение механизма транспорта различных веществ. Могут быть нарушены ферментативная активность, синтез ферментов и регуляция их метаболизма, а также репликация и транскрипция нуклеиновых кислот. Поврежденные клетки становятся чрезмерно чувствительными к факторам внешней среды и могут быть инактивированы при последующей обработке. Тем не менее со временем и в благоприятных условиях часть клеток после частичных повреждений может восстанавливаться и становиться способными к размножению.
Эти явления на практике могут использоваться по-разному. В первую очередь они составляют основу комбинированных технологий консервирования, то есть совместного применения щадящих способов и средств консервирования в дозировках, которые по отдельности были бы неэффективными. При приготовлении партий промышленно используемых микроорганизмов (например, сухих пекарских дрожжей или дрожжей для замораживаемого теста) также необходимы методы, не повреждающие клетки. Следует отметить, что если условия культивирования не допускают роста поврежденных клеток, то при оценке и контроле микробиологического качества пищевых продуктов существует риск получения ошибочных результатов (см. главу 13).
alternativa-sar.ru
 |  |  |  |  |  |  |  |  |  |  |  |  |  |  |
 Пример видео 3 Пример видео 3 |  Пример видео 2 Пример видео 2 |  Пример видео 6 Пример видео 6 |  Пример видео 1 Пример видео 1 |  Пример видео 5 Пример видео 5 |  Пример видео 4 Пример видео 4 |
Администрация муниципального образования «Городское поселение – г.Осташков»



















