гибридный штамм дрожжей saccharomyces carlsbergensis 161 вкпм y-3356, используемый в пивоваренной промышленности. Штаммы пивных дрожжей
как люди одомашнили пивные дрожжи
Кевин Верстрепен (в центре) возглавляет дегустацию пива в его лаборатории.Генетики проследили историю самого важного ингредиента пива — дрожжей. Секвенировав геномы почти 200 современных штаммов пивных дрожжей, исследователи открыли, как на протяжении сотен лет люди превращали дикий грибок Saccharomyces cerevisiae во множество штаммов, предназначенных для производства конкретных алкогольных напитков.
Из-за дрожжей у пива есть опьяняющий эффект и пузырьки, поскольку в процессе ферментации они превращают сахар в алкоголь и углекислый газ. Но они также вырабатывают сотни химических веществ, придающих напитку различный вкус — от банана до гвоздичного дерева.
Пивные дрожжи различаются в производстве метаболитов и по другим признакам, таким как их толерантность к алкоголю. Чтобы понять основу этих различий, руководимая генетиком Кевином Верстрепеном (Kevin Verstrepen) команда исследователей из Лёвенского университета (нидерл. Katholieke Universiteit Leuven) и Фламандского института биотехнологий (фламанд. Vlaams Instituut voor Biotechnologie) в Бельгии секвенировала геномы 157 штаммов S. cerevisiae, используемых в производстве пива и других продуктов ферментации, в том числе вина, саке и хлеба. Их работа подробно описывается в статье, опубликованной 8 сентября в журнале Cell.
Оказалось, что эволюционное древо штаммов дрожжей включает в себя различные семейства одноклеточных грибов, используемых для производства саке, вина и хлеба, и две отдалённо родственные группы пивных дрожжей, в том числе дрожжей из Бельгии, Германии, Британии и США.
«Это генетическая энциклопедия пивных дрожжей, которая будет служить исследователям ещё долгие годы», — сказал Крис Хиттингер (Chris Hittinger), эволюционный генетик из Висконсинского университета в Мадисоне (University of Wisconsin—Madison).
Тем временем команда Верстрепена использует геномику, чтобы создавать новые штаммы пивных дрожжей.
Древний алкогольный напиток
Пиво — один из древнейших алкогольных напитков. На шумерской табличке возрастом пять тысяч лет изображена древняя пивная попойка, в то время как котлы того же возраста из западного Ирана и северного Китая содержат остатки пивных ингредиентов, в том числе ячмень и побочные продукты брожения. Принимая во внимание древнюю историю пивоварения, Верстрепен думал, что предки современных пивных дрожжей появились тысячи лет назад.
Однако его команда определила, что люди начали одомашнивать пивные дрожжи в конце XVI — начале XVII веков. Это совпадает с периодом, когда пивоварение переместилось из домов в пабы и монастыри. Верстрепен предполагает, что ранние профессиональные пивовары брали дрожжи с собой, когда они перемещались по Европе, и даже завезли их в Новый Свет: штаммы пивных дрожжей в США, например, близкородственны британским.
Пивовары не изолировали первые штаммы дрожжей, по крайне мере, до конца XIX века, но они могли невольно сформировать геномы дрожжей, варя каждую новую партию пива с остатками предыдущей, предполагает Верстрепен. Таким образом, пивовары могли постепенно проводить селекцию штаммов дрожжей, которые эффективны и придают пиву желаемый вкус.
Независимая команда исследователей под руководством Жозе Паулу Сампайо (José Paulo Sampaio), эволюционного генетика из Нового университета Лиссабона (порт. Universidade Nova de Lisboa), после того как секвенировала геномы 28 штаммов дрожжей, пришла во многом к тем же выводам, что и команда Верстрепена. Результаты их исследования будут опубликованы в следующем месяце в журнале Current Biology.
Хиттингер сказал, что он не уверен в том, что пивные дрожжи были одомашнены в 1600-х. Эта датировка основана на частоте мутаций ДНК пивных дрожжей, которая в 50 раз быстрее по сравнению с оценками других исследований. Более медленная частота мутаций будет означать, что одомашнивание пивных дрожжей произошло гораздо раньше, чем показывают результаты исследования. Но Верстрепен выступает за эту датировку: мутации дрожжей ускоряются, когда они живут в алкогольной среде, отметил он.
Генетически модифицированное пиво
Хотя почти все промышленные дрожжи обладают признаками вмешательства человека, геномы пивных дрожжей были изменены в наибольшей степени: их штаммы несут вариации и дупликации генов, участвующих в переработке мальтозы и мальтотриозы — основных сахаров в пиве.
Большинство пивных дрожжей несут также генетические вариации, ограничивающие выработку 4-винилгваякола, придающего пиву запах гвоздичного дерева или дыма, вызывающий отвращение у многих любителей этого напитка. Исключением были дрожжи, использовавшиеся в Германии для производства сортов пшеничного пива под названием Хефевайцен (Hefeweizen), обычно пахнущего гвоздичным деревом. Геномы этих штаммов пивных дрожжей содержат отрезки ДНК — в том числе гены, производящие 4-винилгваякол, — происходящие, по-видимому, от винных дрожжей. Верстрепен думает, что эти штаммы возникли, когда пивные дрожжи гибридизировались с винными дрожжами, получив способность производить пахнущее гвоздичным деревом вещество.
Секвенирование дрожжевых геномов может способствовать радикальным переменам в производстве пива. В лаборатории Верстрепена разводятся различные штаммы дрожжей и отбираются гибриды с нужным набором генетических вариаций. Исследователи создали гибридный штамм с высокой толерантностью к алкоголю, не вырабатывающий 4-винилгваякол.
В его лаборатории используются генетически модифицированные дрожжи, для создания пива с высоким содержанием имеющего банановый вкус вещества. Но он распространяет только дрожжи, созданные посредством традиционной селекции на пивоварнях. Лорен Мираглия (Loren Miraglia), генетик и домашний пивовар из Сан-Диего, предоставивший некоторые из секвенированных штаммов, думает о модифицировании пивных дрожжей при помощи инструментов редактирования генома (CRISPR), используемых им в институте геномики. Однако он сомневается, что потребители готовы к CRISPR-пиву.
Хиттингер представляет, что будут выпускаться пивные бутылки с этикетками, информирующими о признаках пивных дрожжей, таких как выработка 4-винилгваякола, которая определяется вариациями генов PAD1 и FDC1. «Это один из основных вкусов, из-за которого мне не нравятся некоторые сорта пива. — Сказал он. — Я бы предпочёл проверять происхождение пива, прежде чем купить его».
Дрожжи — внетаксономическая группа одноклеточных грибов, утративших мицелиальное строение в связи с переходом к обитанию в жидких и полужидких, богатых органическими веществами субстратах. Объединяет около 1500 видов, относящихся к отделам аскомицетам и базидиомицетам.Дрожжи, вероятно, одни из наиболее древних «домашних организмов». Тысячи лет люди использовали их для ферментации и выпечки. Для начала сбраживания нового субстрата люди использовали остатки старого. В результате в различных хозяйствах столетиями происходила селекция дрожжей, и сформировались новые физиологические расы, не встречающиеся в природе, многие из которых даже изначально были описаны как отдельные виды. Эти расы являются такими же продуктами человеческой деятельности, как сорта культурных растений.
22century.ru
штамм дрожжей saccharomyces cerevisiae для применения в пивоваренной промышленности - патент РФ 2340666
Штамм дрожжей Saccharomyces cerevisiae ВКПМ Y-3194 получен селективным отбором гибридов штаммов дрожжей Saccharomyces cerevisiae В7 и Saccharomyces cerevisiae 12В-В72. Штамм характеризуется повышенной степенью сбраживания сахаров и высоким образованием этанола в результате сбраживания. Степень сбраживания сахаров составляет 65%. Количество образовавшегося этанола 4,79%. 5 табл., 5 ил. 
Изобретение относится к промышленной микробиологии, в частности к получению штамма дрожжей Saccharomyces cerevisiae, обладающего улучшенными технологическими свойствами для пивоваренной промышленности.
Известно множество штаммов пивных дрожжей Saccharomyces cerevisiae, применяемых в пивоварении. В мире существует несколько коллекций пивоваренных дрожжей, наиболее известными из которых являются UK National Collection of Yeast Culturies (NCYC) http://www.ifr.bbsrc.ac.uk/ncyc/, VTT Biotechnology www.vtt.fi, Hefebank Weihnstephan www.hefebank-weihenstephan.de, Cara Technology www.cara-online.com, Всероссийская Коллекция Промышленных Микроорганизмов (ВКПМ ФГУП ГосНИИГенетика) www.genetika.ru.
Одним из широко используемых в пивоваренной промышленности является штамм Saccharomyces cerevisiae ВКПМ Y-2945 ин-та Пищевой биотехнологии, раса «Голландская», хранящийся во Всероссийской Коллекции Промышленных Микроорганизмов ФГУП ГосНИИГенетика (прототип).
Указанный штамм обладает способностью эффективно утилизировать моно-, ди- и трисахариды пивного сусла, с образованием этилового спирта, характеризуется низким содержанием эфиров и высших спиртов в готовом продукте, обладает высокой способностью к редукции диацетила и пентандиона и хорошими флокулирующими свойствами.
Недостатком штамма является достаточно высокое содержание серосодержащих соединений в пиве, полученном с использованием этого штамма. Изменением технологических режимов не удается эффективно понизить уровень синтеза серных соединений и улучшить органолептические свойства конечного продукта.
В ходе брожения дрожжей в пивном сусле образуется сероводород. В повышенной концентрации неприятный запах и токсичность этого соединения приводит к непригодности пива для потребителя. Количество сероводорода зависит от особенностей метаболизма штамма, от состава пивного сусла и от условий брожения, поэтому получение штамма, способного сбраживать пивное сусло в стандартных условиях с низким образованием серосодержащих соединений является важной задачей для пивоваренной промышленности.
Технической задачей изобретения является расширение ассортимента штаммов, пригодных для применения в пивоваренной промышленности.
Поставленная задача решается тем, что получен штамм Saccharomyces cerevisiae ВКПМ Y-3194, обладающий высокими технологическими характеристиками (в том числе повышенной степенью сбраживания сахаров пивного сусла) и позволяющий получить продукт (пиво) с улучшенными органолептическими свойствами.
Штамм дрожжей Saccharomyces cerevisiae ВКПМ Y-3194 представляет собой гибрид двух штаммов дрожжей Saccharomyces cerevisiae В7х12В-В72. Один из родительских штаммов В7 является прототрофом, второй родительский штамм 12В-В72 - ауксотроф по гистидину МАТа his4. Оба штамма получены из коллекции лаборатории молекулярной генетики Санкт-Петербургского Института Ядерной Физики им. Константинова. На основе прототрофного штамма В7 были выделены клоны, дефектные по митахондриальной ДНК и неспособные расти на среде с этиловым спиртом в качестве единственного источника углерода.
Штамм ВКПМ Y-3194 получен с использованием селективной системы отбора гибридов ауксотрофного штамма и прототрофного штамма, неспособного расти на минимальной среде с этанолом. Селекцию гибридов проводили по следующим признакам: технологичность (способность штамма расти в производственных условиях и эффективно сбраживать моно-, ди- и трисахариды сусла с образованием большого количества этилового спирта) и хорошие органолептические свойства (приятный вкус и аромат конечного продукта брожения).
Полученный штамм депонирован во Всероссийской коллекции промышленных микроорганизмов ФГУП ГосНИИГенетика (Москва, 117545, 1-ый Дорожный проезд, 1) и имеет регистрационный номер ВКПМ Y-3194.
Штамм характеризуется следующими признаками.
Культурально-морфологические признаки.
При выращивании на полной среде YEPD (мас.%: глюкоза - 2; пептон - 2; дрожжевой экстракт - 1; агар -2,0, вода - остальное), сусле-агаре (мас.%: сусло -11; агар - 2, вода - остальное) и минимальной среде (мас.%: BYNB - 0,67; глюкоза - 2; агар -2,0, вода - остальное) при 29±1°С в течение 96 часов образуются колонии светло-кремовые, гладкие с ровным краем.
При микроскопировании клетки неподвижные, крупные правильной овальной формы с округлыми концами. Клетки образуют по одной почке. Клетки в среднем крупнее, чем у подобных штаммов пивоваренных дрожжей.
Увеличенный размер клеток штамма Saccharomyces cerevisiae ВКПМ Y-3194 по сравнению со штаммами других пивных дрожжей является морфологическим признаком данной культуры. Увеличенные размеры объекта, полученные в результате селекционного отбора, часто свидетельствуют о повышенной плоидности. Документирование результатов микроскопирования с помощью микроскопа Axioskop 2 МОТ проводили с помощью видеокамеры Axiocam фирмы Zeiss. Измерения проводили с помощью программы Axiovision (Zeiss).
Физиолого-биохимические признаки
Мезофил, рост возможен в интервале 10-40°С, оптимальная для роста и спорообразования температура 29±1°С, однако, устойчив к повышенной температуре и способен к росту при 37°С.
Оптимальный диапазон рН 4,7-5,5.
Факультативный аэроб, при глубинной ферментации на жидкой питательной среде оптимальный режим аэрации-перемешивания на шейкере INOVA 200 об./мин.
Имеет повышенный уровень устойчивости к меди (способен к росту на среде с концентрацией меди 305 мг/л), что является его индивидуальной характеристикой и важно при проведении микробиологических тестов на выявление заражения посторонними дрожжами в процессе пивоварения.
Обладает повышенной устойчивостью к этанолу, что также является важной характеристикой для штамма, используемого в пивоварении.
Отношение к источникам углеводов.
Для определения видовой принадлежности культуры Saccharomyces cerevisiae ВКПМ Y-3194 использовали Api 20С AUX системы для идентификации дрожжевых грибов фирмы Bio Merieux.
Полоска (стрип) API 20С AUX состоит из 20 лунок, содержащих высушенные субстраты, которые позволяют провести 19 ассимиляционных тестов. Лунки заливают полужидкой минимальной средой, при этом дрожжевые грибы показывают признаки роста только на тех субстратах, которые они способны использовать в качестве единственного источника углерода. Реакции учитывают путем сравнения характера роста с контролем через 24, 48 и 96 часов, идентификацию проводят, используя компьютерную программу для идентификации APILAB plus. V3.2.2.
Дрожжи ВКПМ Y-3194 утилизировали глюкозу, галактозу, глицерин, а-метил-D-глюкозид, мальтозу, сахарозу, трегалозу, раффинозу.
Отрицательные результаты теста были выявлены на: 2-кето-Д-глюканате, L-арабинозе, D-ксилозе, адоните, ксилите, инозите, сорбите, N-ацетил-D-глюкозамине, целлобиозе, лактозе, мелицитозе.
При проведении кариотипирования генетического материала штамма Saccharomyces cerevisiae ВКПМ Y-3194 показано, что в его кариотипе имеются диморфные хромосомы.
Штамм хранится в пробирках на скошенной агаризованной среде YEPD, при температуре 4±2°С 1 год.
Изобретение иллюстрируется следующими примерами.
Пример 1. Исследование действительной степени сбраживания пивного сусла штаммом ВКПМ Y-3194 и его способности к образованию этанола.
Посевную культуру Saccharomyces cerevisiae ВКПМ Y-3194 выращивают 48 часов при 24°С в пробирке со скошенным агаром, затем асептично переносят смыв клеток с поверхности агара в две 1 л колбы с 250 мл 12%-ного сусла и выращивают при периодическом перемешивании (5 мин через 2 часа) при 24°С в течение 24 час.
Выращенную культуру инокулируют в две 5 л колбы с 1,5 л 12%-ного сусла и снова выращивают 24 часа при периодическом перемешивании (5 мин через 2 часа) при 24°С.
Культуру из обеих колб переносят в колбу Карлсберга с 18 л 12%-ного сусла, выращивают 24 часа при комнатной температуре и передают на минипивзавод для дальнейшего культивирования.
Культивирование штамма Saccharomyces cerevisiae ВКПМ Y-3194 осуществляют на минипивзаводе Berplan Harter GMBH в 500 л цилиндроконическом танке с 120 л 12%-ного сусла при температуре 14°С.
Для дальнейшего анализа через определенные промежутки времени асептично отбирают пробы объемом 200 мл.
Действительную степень сбраживания (RDF - real degree of fermentation in %) и концентрацию этанола в продукте определяют с помощью алколайзера фирмы AntonPaar.
В качестве контрольного штамма используют штамм Saccharomyces cerevisiae ВКПМ Y-2945 (прототип).
Результаты возрастания действительной степени сбраживания сусла штаммом ВКПМ Y-3194 по сравнению с контрольным штаммом приведены в табл.1. Из представленных результатов видно, что штамм ВКПМ Y-3194 быстрее сбраживает пивное сусло, т.е. является более технологичным.
| Таблица 1 | ||
| Сравнение действительной степени сбраживания контрольного штамма и штамма ВКПМ Y-3194 | ||
| Время (ч) | Действительная степень сбраживания % (контрольный штамм) RDF% | Действительная степень сбраживания % (штамм ВКПМ Y-3194) RDF% |
| 2 | 10 | 13 |
| 19 | 14 | 29 |
| 87 | 27 | 39 |
| 109 | 34 | 44,5 |
| 133 | 39 | 49 |
| 157 | 44 | 52 |
| 181 | 48 | 56,6 |
| 205 | - | 60 |
| 253 | - | 64 |
| 277 | 62 | 65 |
В табл.2 представлена информация о количестве этанола, образующемся при культивировании указанных штаммов. Из приведенных результатов следует, что штамм ВКПМ Y-3194 образует этанол с большей скоростью.
| Таблица 2 | ||
| Образование этанола при культивировании контрольного штамма и штамма ВКПМ Y-3194 | ||
| Время (ч) | % этанола v/v (контрольный штамм) | % этанола v/v (штамм ВКПМ Y-3194) |
| 2 | 0,85 | 1 |
| 19 | 1,21 | 2,16 |
| 87 | 2,24 | 2,9 |
| 109 | 2,82 | 3,3 |
| 133 | 3,25 | 3,6 |
| 157 | 3,67 | 3,9 |
| 181 | 4,02 | 4,2 |
| 205 | - | 4,5 |
| 253 | _- | 4,79 |
Высокое образование этанола в результате эффективного сбраживания субстрата является важнейшим технологическим свойством штамма при производстве пива (Dragone G., Silva D.P., de Almeida e Silva J.B., de Almeida Lima U. Improvement of the ethanol productivity in a high gravity brewing at pilot plant scale/ Biotechnology Letters 25: 1171-1174, 2003).
Пример 2. Исследование способности штамма ВКПМ Y-3194 к редукции диацетила.
Во время брожения образуются альдегиды и кетоны, оказывающие нежелательное влияние на аромат пива. Вицинальные дикетоны 2,3-бутадион (диацетил) и 2,3-пентандион придают пиву нежелательную «маслянистую ноту», поэтому способность к быстрой редукции диацетила важна для штамма, используемого в пивоваренной промышленности
Культивирование проводят по примеру 1. Концентрацию диацетила определяют методом газовой хроматографии на хроматографе Shumadzu.
Данные представлены в табл.3.
Из таблицы 3 видно, что штамм Y-3194 редуцирует диацетил на трое суток быстрее. Это технологическое свойство штамма имеет большое значение для производства пива в промышленном масштабе, так как позволяет увеличить мощность предприятия за счет сокращения продолжительности цикла производства.
| Таблица 3 | ||
| Скорость редукции диацетила при культивировании контрольного штамма и штамма ВКПМ Y- 3104 | ||
| Время (ч) | Концентрация диацетила (мг/л) (контрольный штамм) | Концентрация диацетила (мг/л) (штамм ВКПМ Y-3194) |
| 2 | - | - |
| 19 | - | |
| 87 | - | 250 |
| 109 | - | 252 |
| 133 | - | 291 |
| 157 | - | 210 |
| 181 | - | 205 |
| 253 | - | 95 |
| 277 | - | 57 |
| 304 | 120 | - |
| 328 | 90 | - |
| 352 | 61 | - |
Кроме того, концентрация диацетила в конечном продукте, произведенном с использованием штамма ВКПМ Y-3194 меньше, чем в продукте, полученном при использовании контрольного штамма, что очень важно, так как наличие диацетила в пиве является существенным органолептическим дефектом (Petersen Е.Е., Margaritis F., Stewart R.J., Pilkington P.H., Mensour N.A. The effects of wort valine concentration on the total diacetyl profile and levels late in batch fermentations with brewing yeast Saccharomyces carlsbergensis. /Y.Am. Soc. Brew. Chem. 62(4): 131-139, 2004).
Пример 3. Исследование образования серосодержащих соединений штаммом ВКПМ Y-3194.
Культивирование проводят по примеру 1. Содержание сероводорода определяют с помощью газовой хроматографии. Отбор проб производят в герметично закрывающуюся стеклянную банку Simax. Концентрацию сероводорода определяют на газовом хроматографе фирмы Shumadzu. Результаты, приведенные в табл.4, показывают, что при культивировании штамма ВКПМ Y-3194 образуются небольшие концентрации сероводорода, а следовательно, пиво, полученное с его использованием, обладает лучшими органолептическими свойствами (Duan W., Roddick F. A., Higgins V., Rogers P.J. A partial analysis of H 2S and SO2 formation by brewing yeast in response to sulfur-containing amino acids and ammonium ions. / J. Am. Soc. Brew. Chem. 62(1):35-41, 2004).
| Таблица 4 | |
| Динамика образования сероводорода при культивировании штамма ВКПМ Y-3194 | |
| Время (час) | Концентрация сероводорода (мкг/л) (штамм ВКПМ Y-3194)* |
| 18 | - |
| 89 | 5 |
| 113 | 2,8 |
| 137 | 2 |
| 163 | - |
| 187 | - |
| 216 | 1,8 |
 ) Испытания проводили в цилиндроконическом танке номер 69.
) Испытания проводили в цилиндроконическом танке номер 69.
Пример 4. Исследование синтеза эфиров и высших спиртов.
При культивировании дрожжей в культуральной жидкости образуются альдегиды, спирты, кислоты и, в ходе реакции между спиртами и кислотами, эфиры. Для формирования аромата пива существенно, чтобы количество этих соединений было невысоким, так как они негативно влияют на аромат и вкус пива.
Культивирование проводят по примеру 1. Содержание высших спиртов, альдегидов и эфиров, оказывающих наибольшее влияние на аромат и вкус пива, определяют с помощью газовой хроматографии. Результаты представлены в табл.5.
Из представленных данных видно, что при брожении штамма ВКПМ Y-3194 соединения, негативно изменяющие органолептические свойства пива, образуются в небольших концентрациях, т.е. пиво, произведенное с использованием штамма ВКПМ Y-3194, обладает пониженным содержанием тестируемых компонентов и имеет индивидуальный профиль ароматности.
| Таблица 5 | |||
| Содержание эфиров, альдегидов и высших спиртов в пиве, произведенном с использованием контрольного штамма и штамма ВКПМ Y-3194 | |||
| Концентрация альдегидов (мг/л) | Концентрация эфиров (мг/л) | Концентрация спиртов (мг/л) | |
| ВКПМ Y-3194 | 2,2 | 13,1 | 93 |
Пример 5. Дегустационная оценка органолептических свойств пива.
Органолептическая оценка пива, произведенного с использованием штамма ВКПМ Y-3194, проведенная дегустационной комиссией показала, что пиво обладает пониженным содержанием сероорганических компонентов и имеет индивидуальный ароматический профиль.
Таким образом, получен штамм Saccharomyces cerevisiae штамм ВКПМ Y-3194, имеющий следующие характерные особенности:
- оптимальный рост на производственных средах в условиях глубинной ферментации;
- быстрое и эффективное сбраживание моно-, ди- и трисахаридов пивного сусла с образованием большого количества этанола;
- пониженное содержание диацетила в конечном продукте;
- пониженное образование серосодержащих соединений;
- пониженный синтез альдегидов, эфиров и высших спиртов
Пиво, полученное с использованием штамма ВКПМ Y-3194, имеет улучшенные органолептические свойства: сбалансированный вкус и тонкий аромат, а также обладает высокой органолептической стабильностью.
ФОРМУЛА ИЗОБРЕТЕНИЯ
Штамм дрожжей Saccharomyces cerevisiae ВКПМ Y-3194 для применения в пивоваренной промышленности.
www.freepatent.ru
Записки одомашненных дрожжей
Наталья Резник«Химия и жизнь» №12, 2016


Можно ли одомашнить создание, о существовании которого даже не подозреваешь? Оказывается, можно. Именно это произошло с дрожжами Saccharomyces cerevisiae. Их способность превращать сахара в спирт и ароматные соединения люди начали совершенствовать за несколько веков до открытия этих микроорганизмов, хотя и значительно позже, чем появилось первое пиво. И этот процесс можно с полным правом назвать доместикацией.
Доместикация или домашний арест?
Процесс одомашнивания животных и культурных растений описан достаточно подробно, история взаимодействия человека с микроорганизмами, участвующими в приготовлении продуктов, почти неизвестна. Штаммы дрожжей, которые используют для производства спирта, пива и хлеба, отличаются от своих лабораторных и диких собратьев, а также друг от друга. Однако эти различия могли возникнуть не только в ходе целенаправленного отбора ценных для человека признаков, но и в результате географической изоляции дрожжей и ограниченного их разнообразия в каждой области. Если бельгийские дрожжи, однажды попав на пивоварню, никогда ее не покинут, то со временем они поневоле станут отличаться от, скажем, британских. Так чему же промышленные дрожжи обязаны своими особенностями? К сожалению, пивовары и хлебопеки древности не оставили записок, однако можно прочесть дрожжевой геном, а лучше несколько.
Доместикация — это направленный отбор по нужным человеку признакам и адаптация к определенным условиям жизни, часто весьма далеким от природных. В каком бы направлении (урожайность, окраска меха, размер тела) этот отбор ни шел, он всегда приводит к характерным изменениям, хорошо известным на примерах многих одомашненных животных и растений. У них ярко выражены признаки, полезные людям, но не нужные их обладателям (во всяком случае, не в такой степени). У них нарушено половое размножение. Эти признаки позволяют существовать в среде, созданной человеком, однако в естественных условиях одомашненные виды чувствуют себя, в лучшем случае, некомфортно.
Доместикация оставляет характерные пометки в геноме: некоторые участки ДНК удваиваются, а другие теряются, меняется копийность генов, а иногда и целых хромосом. Иными словами, геном портится. Если генотипические и фенотипические особенности, характерные для одомашненных видов, обнаружатся и у промышленных штаммов дрожжей, это послужит доказательством их доместикации.
Дрожжевое древо
Такое исследование предприняли ученые из Бельгии и Соединенных Штатов под руководством Кевина Верстрепена, адъюнкт-профессора Католического университета Левена, и Стивена Маре из Гентского университета (Cell, 2016, 166, 1397–1410, doi: 10.1016/j.cell.2016.08.020). Они секвенировали и описали геномы 157 штаммов дрожжей S. cerevisiae, которые используют для производства теста, вина, пива, спирта, саке и биоэтанола, и сравнили их с дикими и лабораторными штаммами, собранными на разных континентах. Дрожжи могут существовать в диплоидном и гаплоидном состоянии; исследователи работали с диплоидными, чтобы оценить все особенности строения генома.
Анализ геномов показал, что промышленные дрожжи генетически отличаются от диких родичей и произошли от немногих предковых штаммов, которые адаптировались к созданной человеком среде. Исследователи составили филогенетическое древо промышленных дрожжей, которые разделяются на пять клад (рис. 1). (Клада у биологов — группа организмов, включающая общего предка и всех его прямых потомков.) Одна из них включает азиатские штаммы производителей саке, другая — преимущественно винные дрожжи. Есть одна смешанная клада, объединяющая все пекарские штаммы и некоторые пивные, в основном те, которые используют для изготовления крепкого бельгийского эля. Выделяются также две большие группы пивных дрожжей, «Пиво 1» и «Пиво 2».
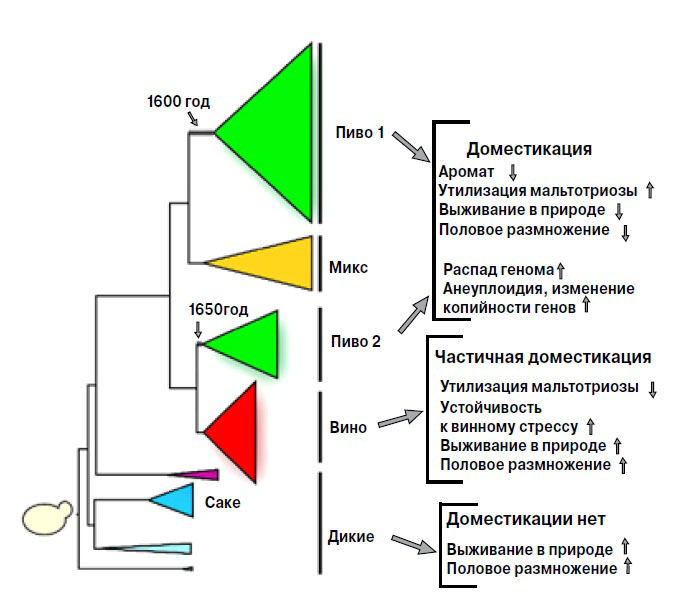
Спиртовые штаммы не образуют особой группы и разбежались по всему древу. Очевидно, они возникли в результате отбора, которым занимаются различные компании, продающие дрожжи для производства спирта. Кроме того, спиртовые дрожжи, в отличие от пивных или пекарских, повторно не используют, так что у них было меньше возможностей образовать особую группу.
Своим разнообразием промышленные штаммы отчасти обязаны географическим различиям. Большинство дрожжей для саке родом из Азии, у них один общий предок, и они в родстве с дикими и биоэтанольными штаммами из Китая. А североамериканские дрожжи для производства этанола родственны тем, которые используют в Бразилии для получения спирта из сахарного тростника. Клада «Пиво 1» распадается на три подгруппы: штаммы континентальной Европы (Бельгии и Германии), Великобритании и Соединенных Штатов. Пивные дрожжи Северной Америки, в отличие от биоэтанольных, явно произошли от британских штаммов, а не от местных. Клада «Пиво 1» рано обособилась от других групп и развивалась независимо. Клада «Пиво 2» возникла позже и связана с винными дрожжами, в нее входит пятая часть всех винных штаммов. Она объединяет дрожжи из Бельгии, Великобритании, Соединенных Штатов, Германии и Восточной Европы, но четкого географического подразделения внутри нее нет. Наличие двух больших, генетически различных источников пивных дрожжей говорит о том, что их одомашнивание происходило в Европе, дважды и независимо, причем одно из этих событий дало начало как винным, так и пивным дрожжам («Пиво 2»).
На каждой пивоварне для производства разных сортов пива обычно используют один и тот же штамм, поэтому дальнейшего дробления внутри пивных клад не произошло. Исключение составляют дрожжи для производства нескольких местных сортов пива, таких, как бельгийский сайзон и британский стаут.
Пивные — домашние, винные — уличные
Оценивая фенотипические признаки дрожжей, исследователи обнаружили несомненное влияние доместикации. Сильнее всего оно проявилось у пивных штаммов, и связано это со спецификой пивоварения.
Пиво варят круглый год, причем старую пивную гущу с дрожжами не выбрасывают, а используют для сбраживания новой порции. Таким образом, пивные дрожжи долгое время и без перерывов находились в стабильной и сытной среде. Ученые подсчитали, что со времени начала отбора прошло не менее 75 тысяч дрожжевых поколений. Оказавшись в новых условиях, пивные дрожжи за ненадобностью утратили многие признаки, необходимые для выживания в суровой естественной среде. Прежде всего, значительная часть пивных штаммов полностью распрощалась с половым размножением.
В природных условиях S. cerevisiae размножаются как бесполым путем, так и половым. В благоприятной обстановке они почкуются: на рисунке в начале статьи видны круглые шрамики, оставленные отпочковавшимися дочерними клетками. В стрессовой ситуации (холод, голод или недостаток влаги) дрожжи переключаются на половое размножение и образуют споры, которые позволяют пережить тяжелый период. В пивоварне, где дрожжи всегда при деле, они прекрасно обходятся без полового размножения, более половины штаммов «Пива 1» только почкуются, у остальных споры часто нежизнеспособны. Такая особенность в других промышленных кладах редка (не более 21%), а у диких дрожжей не встречается вовсе.
Спиртовые и винные штаммы не могут себе позволить отказаться от полового размножения. Чистые дрожжевые культуры виноделы стали использовать только с начала ХХ века, до этого они несколько тысяч лет обходились природными дрожжами. Винные дрожжи растут только в вине, а сезон виноделия короток. Значительную часть года они проводят на виноградниках и в кишечнике насекомых. Во время этих голодных периодов винные дрожжи почти не почкуются, но могут размножаться половым путем и даже скрещиваться с дикими дрожжами. Более того, лишь небольшая часть винных дрожжей в следующем сезоне вновь попадет в виноградное сусло, в то время как в пивоварении этот путь открыт триллионам клеток. Нет, такая жизнь явно не позволяет ограничиться почкованием. В результате на винных дрожжах влияние человека сказывается значительно слабее, чем на пивных. Благодаря половому размножению и скрещиванию с дикими видами, а также и непродолжительному пребыванию в антропогенной винной среде они эволюционируют гораздо медленнее пивных.
Спирты, сахара и аромат гвоздики
Люди не задумывались над тем, могут ли дрожжи образовывать споры. Вот чтобы они быстро росли — это важно. (Размножение почкованием, конечно, быстрее полового.) А еще люди хотят получать вкусный, хорошо усваиваемый, долго хранящийся и успокаивающий благодаря присутствию этанола продукт. Прежде всего от дрожжей требуется синтезировать этиловый спирт, и в результате отбора они научились производить его в больших количествах и существовать в достаточно концентрированном спиртовом растворе. Пивные штаммы производят 7,5–10 объемных процентов этанола, а дрожжи, используемые для приготовления более крепких напитков — саке, спирта, вина и в особенности биоэтанола, могут производить 14,5%-ный раствор. В природе таких условий нет, и эти качества не требуются.


Спирт образуется в результате расщепления сахаров, и дрожжи должны их активно усваивать. Пивные штаммы явно прошли отбор на интенсивное расщепление мальтотриозы, одного из основных сахаров пивного сусла (рис. 2). Эта способность зависит от специфического аллеля AGT1 гена MAL11, который присутствует только в дрожжах «Пива 1» и некоторых штаммах смешанной клады. У винных дрожжей ген MAL11 и даже локус MAL1 полностью отсутствует.
Помимо спирта, дрожжи синтезируют разные вещества, придающие продуктам приятный запах и вкус. Но некоторые ароматы, пусть и самые приятные, не всегда уместны. Одно из ароматических веществ, 4-винил гваякол (4-ВГ), пахнет гвоздикой, и этот запах нежелателен в саке и большинстве видов пива и вина. Синтез 4-ВГ контролируют два гена: декарбоксилаза фенилакриловой кислоты PAD1 и декарбоксилаза феруловой кислоты FDC1. Оба располагаются рядышком в IV хромосоме и помогают обезвреживать токсичную фенилакриловую кислоту, которая встречается в стенках растительных клеток. Так что в природных условиях активность этих генов жизненно необходима, но большинство промышленных штаммов, особенно пивные и саке, утратило способность синтезировать 4-ВГ. Исследователи обнаружили в их геноме мутации, нарушающие функции PAD1 и FDC1. Более того, разные сублинии несут разные мутации, которые независимо возникали в ответ на отбор против синтеза 4-ВГ. Анализ генома показал, что мутации в обоих генах произошли очень рано, в самом начале расхождения S. cerevisiae и родственного вида S. paradoxus от общего предка. Пекарские и биоэтанольные дрожжи сохранили гены PAD1 и FDC1 в целости: в этих производствах 4-ВГ не помеха. Запах 4-ВГ исчезает в процессе выпечки, а биоэтанол не предназначен для внутреннего употребления, и аромат гвоздики никого не беспокоит.
Некоторые любители пива ценят пряный аромат. Нефильтрованное пшеничное пиво хефевайцен традиционно пахнет гвоздикой и содержит значительное количество 4-ВГ. Дрожжи хефевайцена входят в кладу «Пиво 1», но они мозаики, геном этого штамма собран из фрагментов представителей всех трех субклад, в основном бельгийско-германской. Небольшую часть генома они получили от винных дрожжей, однако именно эта часть содержит функциональные гены PAD1 и FDC1. Ученые полагают, что дрожжи хефевайцена возникли в результате скрещивания между разными пивными и винными штаммами — получился гибрид, сочетающий типичную для пивных дрожжей способность ферментировать мальтотриозу и гены синтеза 4-ВГ.
В геномах промышленных штаммов ученые обнаружили все нарушения, свойственные одомашненным видам: полиплоидию и нехватку хромосом, перестройки, делеции и дупликации, изменения копийности генов. Например, многие гены, вовлеченные в переработку мальтотриозы, амплифицированы у пивных и саке-дрожжей, но зачастую потеряны у винных. Однако копийность генов, ответственных за базовый метаболизм углерода и азота, транспорт ионов и флокуляцию (способность дрожжей по окончании ферментации собираться в комочки и оседать на дно емкости, где происходило брожение), сохранилась.
Одомашнивание до открытия
Итак, дрожжи обладают всеми специфическими чертами доместицированного организма: расстроенным геномом, хозяйственно-ценными признаками, адаптацией к жизни в антропогенной среде и утратой полового размножения (рис. 1). Их разнообразие и отличительные признаки вызваны в большей степени одомашниванием, чем географической изоляцией. Вопрос в том, когда это одомашнивание произошло.
Люди варили пиво уже за три тысячи лет до нашей эры. Они делали вино и пекли хлеб, используя для брожения природные дрожжи, старую закваску или пивной осадок, но о существовании дрожжей не догадывались. В 1680 году дрожжи наконец разглядел и зарисовал Антони ван Левенгук. В 1837 году их увидал французский ученый Каньяр де ля Тур и понял, что перед ним живые организмы и пиво создают именно они. Его гипотеза получила подтверждение только 1857 году, когда Луи Пастер доказал микробиологическую природу спиртового брожения. До этого брожение считали химической реакцией. В 1881 году датский микробиолог Эмиль Хансен, сотрудник фирмы «Карлсберг», впервые получил чистую культуру пивных дрожжей, что позволило заметно улучшить качество напитка. Эту культуру назвали Saccharomyces carlsbergensis. Только тогда пивовары, виноделы и пекари узнали, с чем они имеют дело, и смогли приступить к сознательному отбору. Однако анализ генома показал, что одомашнивание дрожжей началось много раньше (см. рис. 1).
Исследователи учли, что американские пивные штаммы произошли от британских, а британские колонисты появились в Америке в начале XVII века. Пивные дрожжи размножаются только почкованием и делятся примерно трижды в неделю, следовательно, за год сменяется примерно 150 поколений. Подсчитав частоту мутаций, ученые определили, что расхождение между субкладами «Пива 1» произошло примерно в 1573–1604 годах. Интересно, что в те же годы домашнее пивоварение постепенно сменяется централизованным. Пиво стали делать при пабах, в монастырях, а затем на больших пивоварнях. Там пиво варили не как дома, от случая к случаю, а непрерывно. Кроме того, профессиональные пивовары должны были обращать особое внимание на качество своей продукции. Все это создало условия для неосознанного пока отбора, то есть доместикации, дрожжей. Заметную роль в одомашнивании сыграла изоляция — появились линии дрожжей, которые постоянно росли в созданных человеком средах, утратив связь с внешним миром. Субклада «Пиво 2» образовалась позже, в 1645–1671 годах, но все равно задолго до работ Пастера и Хансена.
Трудно подсчитать, сколько разных штаммов и в каком контексте было одомашнено, ограниченное количество клад промышленных дрожжей и их четкое отличие от диких родственников позволяет предположить, что современные промышленные дрожжи произошли от небольшого числа предковых штаммов или от их близкородственных групп.
Теперь, когда люди знают не только о существовании дрожжей, но и о функциях, который выполняют различные их гены, и об особенностях геномов разных штаммов, у специалистов есть возможности продолжать отбор «с открытыми глазами» и получать новые промышленные дрожжи невиданного прежде качества.
elementy.ru
Гибридный штамм дрожжей saccharomyces carlsbergensis 161 вкпм y-3356, используемый в пивоваренной промышленности
Штамм дрожжей Saccharomyces carlsbergensis 161 ВКПМ Y-3356 создан путем массового скрещивания моноспоровых культур штаммов пивных дрожжей Saccharomyces carlsbergensis 96 и Saccharomyces carlsbergensis 34/70. Штамм обладает высокой скоростью сбраживания пивного сусла и позволяет сократить длительность процесса сбраживания пивного сусла с содержанием сухих веществ 12-12,5% на 20% и получить продукт, обладающий улучшенными вкусовыми качествами. 1 табл.
Изобретение относится к микробиологии и представляет собой новый штамм пивных дрожжей, предназначенный для использования в пивоваренной промышленности.
Наиболее близкими к предлагаемому штамму являются штаммы пивных дрожжей Saccharomyces carlsbergensis 96 и Saccharomyces carlsbergensis 34/70 (Филимонова Т.И., Несс Е.И., Борисенко О.А., Кобелев К.В. «Пиво и напитки», 2002, №5, с.12-14; Шабурова Л.Н., Гернет М.В., Садова А.И., Ильяшенко Н.Г., Бычков С.Н. «Пиво и напитки», 2000, №2, с 20-21), родительские штаммы по отношению к штамму Saccharomyces carlsbergensis 161 ВКПМ Y-3356. Однако эти штаммы обладают низкой бродильной активностью, что является причиной длительного процесса главного брожения (7-8 суток).
Техническим результатом является создание нового штамма дрожжей, который по сравнению с исходными штаммами обладает более высокой скоростью забраживания пивного сусла и позволяет сократить период процесса главного брожения.
Гибридные дрожжи Saccharomyces carlsbergensis 161 ВКПМ Y-3356 (коллекция чистых культур дрожжей, применяемых при производстве пива, безалкогольных напитков и вина Государственного учреждения «Всероссийский научно-исследовательский институт пивоваренной, безалкогольной и винодельческой промышленности» Российской академии сельскохозяйсвенных наук характеризуются следующими признаками.
Морфологические признаки. Органическая среда: охмеленное солодовое сусло с содержанием сухих веществ 12-12,5%, жидкое или агаризованое.
Клетки на жидком пивном сусле овальной формы. Размеры клеток: ширина 4,2-8,4 мкм, длина 5,6-12,6 мкм, средние размеры 7,0×8,4 мкм. Колонии на сусло-агаре выпуклые, кремового цвета с гладкой матовой поверхностью, круглой формы с ровными краями, диаметром 3-4 мм.
Гигантская колония на сусло-агаре круглая, диаметр колонии 15 суточной культуры 0,9-1,3 см. Колония бежевого цвета, плоская, матовая, край колонии лопастной, заметно выражена радиальная складчатость.
Спорообразование. Гибрид Saccharomyces carlsbergensis 161 ВКПМ Y-3356 при спорообразовании на споруляционной среде: калий уксуснокислый 10 г/дм3, дрожжевой экстракт 2,5 г/дм3, глюкоза 0,1 г/дм3, агар 30 г/дм3 - образует 40-50% асков к общему числу клеток. В асках содержится от 1 до 4 круглых или слегка эллипсоидальных спор с гладкими оболочками диаметром 2,8-3,0 мкм.
Культуральные и физиологические признаки. Штамм размножается почкованием. Активно сбраживает пивное сусло при температуре 8-12°С, является представителем дрожжей низового брожения, флокулирующий.
Отношение к углеводам. Сбраживает глюкозу, фруктозу, мальтозу, сахарозу, маннозу, галактозу и раффинозу, не усваивает лактозу.
Отношение к спиртам, органическим кислотам и источникам азота. Из спиртов усваивает этанол, глицерин, маннит, дульцит и сорбит, из органических кислот слабо усваивает уксусную, молочную, янтарную и винную кислоты, из азотистых веществ усваивает пептон, мочевину, соли аммония.
Бродильная и дыхательная активность. Для размножения дрожжи нуждаются в кислороде: 8-10 мг O2 на 1 литр сусла. При последующем сбраживании кислород не требуется. В результате лабораторной проверки бродильной активности штамма Saccharomyces carlsbergensis 161 ВКПМ Y-3356 в сравнении с исходными штаммами Saccharomyces carlsbergensis 96 и Saccharomyces carlsbergensis 34/70 путем ежедневного учета выделения CO2 весовым методом оказалось, что полученный штамм Saccharomyces carlsbergensis 161 ВКПМ Y-3356 сбраживает пивное сусло быстрее и за 7 суток брожения выделяет CO2 на 1,6-1,8 г/дм3 больше, а длительность главного брожения сокращается с 7 до 5 суток.
| Штаммы Saccharomyces carlsbergensis | Количество г СО2/дм3, выделившейся за период сбраживания | ||
| 2 суток | 5 суток | 7 суток | |
| 161 ВКПМ Y-3356 | 14,0 | 25,6 | 27,3 |
| 34/70 | 10,2 | 23,3 | 25,7 |
| 96 | 10,0 | 23,0 | 25,5 |
Физико-химические показатели пива, полученного с дрожжами штамма Saccharomyces carlsbergensis 161 ВКПМ Y-3356, характеризуются следующими признаками: алкоголь 4,1-4,3%, экстракт видимый 2,1-2,2%, экстракт действительный 4,0-4,1%, видимая степень сбраживания 82,5 -83,2%, действительная степень сбраживания 66,8-67,4%.
Штамм Saccharomyces carlsbergensis 161 ВКПМ Y-3356 позволяет получить пиво хорошо осветленное, с полным, гармоничным вкусом, с устойчивой компактной пеной. Пиво, полученное с использованием предлагаемого штамма, имеет органолептическую оценку 23-24 балла.
Новый гибридный штамм дрожжей Saccharomyces carlsbergensis 161 ВКПМ Y-3356 создан путем скрещивания штаммов пивных дрожжей Saccharomyces carlsbergensis 96 и Saccharomyces carlsbergensis 34/70. Метод получения гибридного штамма - массовое скрещивание моноспоровых культур.
Гибридный штамм хранится в пробирках с косым сусло-агаром при температуре 4-6°С в течение 6 месяцев с последующим пересевом.
Сбраживание сусла. В бродильную емкость с пивным суслом с содержанием сухих веществ 12-12,5% при температуре 8-9°С вносят дрожжевую разводку штамма 161 ВКПМ Y-3356 в количестве 20 млн/см3. Во время сбраживания придерживаются следующего температурного режима: 1 сутки брожения - 8-9°С, 2 сутки брожения - 9-10°С, 3 сутки брожения - 10-12°С, 4 сутки брожения - 10-12°С, 5 и 6 сутки постепенное снижение температуры до 3-5°С. Температурный режим может изменяться в зависимости от интенсивности брожения. После сбраживания сусла дрожжи образуют плотный осадок на дне бродильной емкости.
Дображивание молодого пива. Сброженное молодое пиво с массовой долей сухих веществ 3,5-4,0% передают на дображивание при температуре 1-2°С и шпунтовом давлении 0,04-0,05 МПа по действующей на предприятии технологии.
Штамм Saccharomyces carlsbergensis 161 ВКПМ Y-3356 обладает более высокой скоростью забраживания пивного сусла, позволяет сократить период процесса главного брожения на 20% и получить пиво с полным, гармоничным вкусом.
Штамм хранится в коллекции чистых культур дрожжей, применяемых при производстве пива, безалкогольных напитков и вина Государственного учреждения «Всероссийский научно исследовательский институт пивоваренной, безалкогольной и винодельческой промышленности» Российской академии сельскохозяйственных наук.
Штамм дрожжей Saccharomyces carlsbergensis 161 ВКПМ Y-3356, используемый в пивоваренной промышленности.
www.findpatent.ru
гибридный штамм дрожжей saccharomyces carlsbergensis 161 вкпм y-3356, используемый в пивоваренной промышленности - патент РФ 2383614
Штамм дрожжей Saccharomyces carlsbergensis 161 ВКПМ Y-3356 создан путем массового скрещивания моноспоровых культур штаммов пивных дрожжей Saccharomyces carlsbergensis 96 и Saccharomyces carlsbergensis 34/70. Штамм обладает высокой скоростью сбраживания пивного сусла и позволяет сократить длительность процесса сбраживания пивного сусла с содержанием сухих веществ 12-12,5% на 20% и получить продукт, обладающий улучшенными вкусовыми качествами. 1 табл.
Изобретение относится к микробиологии и представляет собой новый штамм пивных дрожжей, предназначенный для использования в пивоваренной промышленности.
Наиболее близкими к предлагаемому штамму являются штаммы пивных дрожжей Saccharomyces carlsbergensis 96 и Saccharomyces carlsbergensis 34/70 (Филимонова Т.И., Несс Е.И., Борисенко О.А., Кобелев К.В. «Пиво и напитки», 2002, № 5, с.12-14; Шабурова Л.Н., Гернет М.В., Садова А.И., Ильяшенко Н.Г., Бычков С.Н. «Пиво и напитки», 2000, № 2, с 20-21), родительские штаммы по отношению к штамму Saccharomyces carlsbergensis 161 ВКПМ Y-3356. Однако эти штаммы обладают низкой бродильной активностью, что является причиной длительного процесса главного брожения (7-8 суток).
Техническим результатом является создание нового штамма дрожжей, который по сравнению с исходными штаммами обладает более высокой скоростью забраживания пивного сусла и позволяет сократить период процесса главного брожения.
Гибридные дрожжи Saccharomyces carlsbergensis 161 ВКПМ Y-3356 (коллекция чистых культур дрожжей, применяемых при производстве пива, безалкогольных напитков и вина Государственного учреждения «Всероссийский научно-исследовательский институт пивоваренной, безалкогольной и винодельческой промышленности» Российской академии сельскохозяйсвенных наук характеризуются следующими признаками.
Морфологические признаки. Органическая среда: охмеленное солодовое сусло с содержанием сухих веществ 12-12,5%, жидкое или агаризованое.
Клетки на жидком пивном сусле овальной формы. Размеры клеток: ширина 4,2-8,4 мкм, длина 5,6-12,6 мкм, средние размеры 7,0×8,4 мкм. Колонии на сусло-агаре выпуклые, кремового цвета с гладкой матовой поверхностью, круглой формы с ровными краями, диаметром 3-4 мм.
Гигантская колония на сусло-агаре круглая, диаметр колонии 15 суточной культуры 0,9-1,3 см. Колония бежевого цвета, плоская, матовая, край колонии лопастной, заметно выражена радиальная складчатость.
Спорообразование. Гибрид Saccharomyces carlsbergensis 161 ВКПМ Y-3356 при спорообразовании на споруляционной среде: калий уксуснокислый 10 г/дм3 , дрожжевой экстракт 2,5 г/дм3, глюкоза 0,1 г/дм 3, агар 30 г/дм3 - образует 40-50% асков к общему числу клеток. В асках содержится от 1 до 4 круглых или слегка эллипсоидальных спор с гладкими оболочками диаметром 2,8-3,0 мкм.
Культуральные и физиологические признаки. Штамм размножается почкованием. Активно сбраживает пивное сусло при температуре 8-12°С, является представителем дрожжей низового брожения, флокулирующий.
Отношение к углеводам. Сбраживает глюкозу, фруктозу, мальтозу, сахарозу, маннозу, галактозу и раффинозу, не усваивает лактозу.
Отношение к спиртам, органическим кислотам и источникам азота. Из спиртов усваивает этанол, глицерин, маннит, дульцит и сорбит, из органических кислот слабо усваивает уксусную, молочную, янтарную и винную кислоты, из азотистых веществ усваивает пептон, мочевину, соли аммония.
Бродильная и дыхательная активность. Для размножения дрожжи нуждаются в кислороде: 8-10 мг O2 на 1 литр сусла. При последующем сбраживании кислород не требуется. В результате лабораторной проверки бродильной активности штамма Saccharomyces carlsbergensis 161 ВКПМ Y-3356 в сравнении с исходными штаммами Saccharomyces carlsbergensis 96 и Saccharomyces carlsbergensis 34/70 путем ежедневного учета выделения CO2 весовым методом оказалось, что полученный штамм Saccharomyces carlsbergensis 161 ВКПМ Y-3356 сбраживает пивное сусло быстрее и за 7 суток брожения выделяет CO2 на 1,6-1,8 г/дм3 больше, а длительность главного брожения сокращается с 7 до 5 суток.
| Штаммы Saccharomyces carlsbergensis | Количество г СО2/дм3, выделившейся за период сбраживания | ||
| 2 суток | 5 суток | 7 суток | |
| 161 ВКПМ Y-3356 | 14,0 | 25,6 | 27,3 |
| 34/70 | 10,2 | 23,3 | 25,7 |
| 96 | 10,0 | 23,0 | 25,5 |
Физико-химические показатели пива, полученного с дрожжами штамма Saccharomyces carlsbergensis 161 ВКПМ Y-3356, характеризуются следующими признаками: алкоголь 4,1-4,3%, экстракт видимый 2,1-2,2%, экстракт действительный 4,0-4,1%, видимая степень сбраживания 82,5 -83,2%, действительная степень сбраживания 66,8-67,4%.
Штамм Saccharomyces carlsbergensis 161 ВКПМ Y-3356 позволяет получить пиво хорошо осветленное, с полным, гармоничным вкусом, с устойчивой компактной пеной. Пиво, полученное с использованием предлагаемого штамма, имеет органолептическую оценку 23-24 балла.
Новый гибридный штамм дрожжей Saccharomyces carlsbergensis 161 ВКПМ Y-3356 создан путем скрещивания штаммов пивных дрожжей Saccharomyces carlsbergensis 96 и Saccharomyces carlsbergensis 34/70. Метод получения гибридного штамма - массовое скрещивание моноспоровых культур.
Гибридный штамм хранится в пробирках с косым сусло-агаром при температуре 4-6°С в течение 6 месяцев с последующим пересевом.
Сбраживание сусла. В бродильную емкость с пивным суслом с содержанием сухих веществ 12-12,5% при температуре 8-9°С вносят дрожжевую разводку штамма 161 ВКПМ Y-3356 в количестве 20 млн/см3. Во время сбраживания придерживаются следующего температурного режима: 1 сутки брожения - 8-9°С, 2 сутки брожения - 9-10°С, 3 сутки брожения - 10-12°С, 4 сутки брожения - 10-12°С, 5 и 6 сутки постепенное снижение температуры до 3-5°С. Температурный режим может изменяться в зависимости от интенсивности брожения. После сбраживания сусла дрожжи образуют плотный осадок на дне бродильной емкости.
Дображивание молодого пива. Сброженное молодое пиво с массовой долей сухих веществ 3,5-4,0% передают на дображивание при температуре 1-2°С и шпунтовом давлении 0,04-0,05 МПа по действующей на предприятии технологии.
Штамм Saccharomyces carlsbergensis 161 ВКПМ Y-3356 обладает более высокой скоростью забраживания пивного сусла, позволяет сократить период процесса главного брожения на 20% и получить пиво с полным, гармоничным вкусом.
Штамм хранится в коллекции чистых культур дрожжей, применяемых при производстве пива, безалкогольных напитков и вина Государственного учреждения «Всероссийский научно исследовательский институт пивоваренной, безалкогольной и винодельческой промышленности» Российской академии сельскохозяйственных наук.
ФОРМУЛА ИЗОБРЕТЕНИЯ
Штамм дрожжей Saccharomyces carlsbergensis 161 ВКПМ Y-3356, используемый в пивоваренной промышленности.
www.freepatent.ru
Биотехнологии в пивоварении
Получение напитков путем спиртового брожения — одно из древнейших бродильных производств. Первыми из таких напитков были, видимо, вино и пиво. До появления работ Пастера в конце XIX в. о сути протекающих при брожении процессов и их механизмах было известно очень мало. Пастер показал, что брожение без доступа воздуха осуществляется живыми клетками дрожжей, при этом сахар превращается в спирт и углекислый газ. Тогда же было показано, что брожение осуществляется под действием каких-то веществ, находящихся внутри дрожжевых клеток.
 Одно из главных нововведений в области микробиологии брожения было предложено Хансеном, работавшим в исследовательском центре Карлсберг в Копенгагене с дрожжами дикого типа. При производстве пива эти дрожжи доставляли массу неудобств. Хансен выделил чистые культуры дрожжей и использовал их в пивоварении; тем самым он стал пионером применения таких культур при производстве пива.
Одно из главных нововведений в области микробиологии брожения было предложено Хансеном, работавшим в исследовательском центре Карлсберг в Копенгагене с дрожжами дикого типа. При производстве пива эти дрожжи доставляли массу неудобств. Хансен выделил чистые культуры дрожжей и использовал их в пивоварении; тем самым он стал пионером применения таких культур при производстве пива. Алкогольные напитки получают путем сбраживания сахарсодержащего сырья, в результате которого образуются спирт и углекислый газ. Сбраживание осуществляется дрожжами рода Saccharomyces. В одних случаях используется природный сахар (например, содержащийся в винограде, из которого делают вино), в других сахара получают из крахмала (например, при переработке зерновых культур в пивоварении). Наличие свободных сахаров обязательно для спиртового брожения при участии Saccharomyces, так как эти виды дрожжей не могут гидролизовать полисахариды. В производстве спиртных напитков применяют штаммы дрожжей Saccharomyces cerevisiae или S. carlsbergensis. Различие между ними заключается в том, что S. carlsbergensis могут полностью сбраживать раффинозу, a S. cerevisiae к этому не способны.
 Пивной танк
Пивной танк
Для осуществления спиртового брожения при пивоварении прежде всего необходимо, чтобы в пивоваренном сырье образовался сахар. Традиционным источником нужных для этого полисахаридов всегда был ячмень, но в качестве дополнительных используются и другие виды углевод-содержащего сырья. И сегодня ячменный солод составляет основу пива.
Ячменный солод и другие компоненты измельчают и смешивают с водой при температуре до 67 °С. В ходе перемешивания природные ферменты ячменного солода разрушают углеводы зерна. На заключительной стадии раствор, называемый суслом, отделяют от нерастворимых остатков. Добавив хмель, его кипятят в медных котлах. Для производства пива с определенным содержанием алкоголя сусло после кипячения доводят до нужной плотности. Удельная плотность сусла определяется содержанием экстрагированных сахаров, подлежащих сбраживанию. По истечении определенного времени брожение заканчивается, дрожжи отделяют от пива и выдерживают его некоторое время для созревания. После фильтрации и других необходимых процедур пиво готово.
Начатое по инициативе Хансена использование индивидуальных штаммов дрожжей в пивоварении сегодня стало нормой: это культуры S. cerevisiae и S. carlsbergensis. Первые представляют собой дрожжи поверхностного и глубинного брожения: они применяются в производстве эля. Вторые — дрожжи глубинного брожения, их используют в производстве легкого пива. Хотя генетика дрожжей развивается уже в течение многих лет, мы лишь недавно научились осуществлять селекцию дрожжей, используемых в производстве пива. По мере углубления наших знаний о свойствах дрожжей и тех качествах, которые они придают конечному продукту, все успешнее идет работа по выведению новых штаммов пивных дрожжей. В конечном счете мы сможем создать штамм, позволяющий получить идеальный пивной продукт. Требования к таким идеальным дрожжам будут, естественно, зависеть от способа сбраживания и желаемых качеств пива.
К числу наиболее важных свойств дрожжей относятся продуктивность, способность формировать осадок, сбраживать мальтотриозу и т. д. Принимаются во внимание и вкусовые качества получающегося пива, т. е. образование веществ, ответственных за их формирование. Ранее основным способом получения штаммов, дающих продукт нужного качества, был их отбор из существующих пивных дрожжей. Вести отбор было выгоднее, чем заниматься гибридизацией, отчасти из-за малой способности пивных дрожжей к спорообразованию и низкой жизнеспособности аскоспор. В каждом аске образуется от одной до четырех спор, но не все они освобождаются при созревании. Дрожжи из рода Sacharomyces размножаются в основном вегетативно. При этом за счет множественного латерального почкования формируются сферические, эллипсоидные или реже цилиндрические дочерние клетки.
Поскольку для развития технологии пивоварения могут понадобиться штаммы дрожжей, отличающиеся по свойствам от обычно используемых, придется прибегнуть к гибридизации. Основным вкладом биотехнологии в пивоваренную промышленность будет создание штаммов дрожжей, способных давать пиво с желаемыми свойствами.
biofile.ru
Влияние штамма дрожжей на сенсорную стабильность пива
На предыдущуюВлияние штамма дрожжей на сенсорную стабильность пива
Габриела Басаржова, Мартин Блага, Петр Веселы, Институт химии бродильных производств и биоинженерии, Химико-технологический институт, Прага
1. Введение
Свойства штамма дрожжей наряду с качеством сырья и технологическими условиями отвечают за вкусовые особенности пива, а также за его так называемую природную коллоидную стабильность. В процессе брожения дрожжи образуют ряд типичных основных веществ букета пива, таких как эфиры, высшие спирты и жирные кислоты. Отдельные штаммы отличаются разными генетическими особенностями в отношении образования этих веществ, а также в отношении способности к изменению метаболических путей их образования в зависимости от условий производственного процесса. Влияние дрожжей на коллоидную и сенсорную стабильность пива, связано с метаболизмом серосодержащих соединений, результатом которого является образование диоксида серы. Сохранению свежего вкуса пива в течение срока его хранения способствует также ферментативная активность дрожжей, позволяющая окислить карбонильные вещества сусла. В обоих случаях речь идет о свойствах, которые могут различаться у отдельных штаммов как генетически, так и под влиянием их чувствительности к условиям брожения. Диоксид серы вследствие своих антиоксидантных и восстановительных свойств в значительной степени предохраняет пиво от отрицательного влияния растворимого кислорода и ряда карбонильных соединений. Он способен ингиби-роватьхемилюминисценцию, и, следовательно, способен «захватывать» активный кислород, тем самым замедляя окислительные реакции. Уровень диоксида серы в пиве находится в пределах до 20 мг/л, обычно же он составляет менее 15 мг/л. Концентрация выше 30 мг/л, которая обычно на практике не встречается, уже может повредить вкусовым особенностям пива. Образование диоксида серы в значительной мере зависит от генетических свойств используемого штамма дрожжей. Его концентрацию повышает также более высокое значение рН сусла, содержание серосодержащих аминокислот и сульфатов в сусле и, согласно мнению некоторых авторов, более высокая концентрация семенных дрожжей. Низкие значения диоксида серы обуславливаются интенсивной аэрирацией и высокой концентрацией ненасыщенных липидов в сусле.
Штаммы дрожжей отличаются разной способностью к восстановлению карбонильных соединений сусла, образующихся уже в процессе соложения и варки, чаще всего в результате взаимодействия аминокислот и Сахаров (реакция Майяра), разщепления аминокислот по Штреккеру и ферментативного и неферментативного распада липидов. Эти альдегиды являются субстратами для редуктаз дрожжей, которые превращают их в спирты. Известны две ферментативные системы такого рода: алкогольредуктаза, катализирующая восстановление пентанала и пентенала, и аль-доредуктаза, специфичная для 3-метилбутанала и пентанала. Для характеристики отдельных редуктаз этого типа в работах нашего института был разработан и усовершенствован метод очистки дрожжевой НАДФ-3-метилбутаналредук-тазы, и с помощью электрофореза доказано существование двух дрожжевых НАДФ-редуктаз, специфичных для 3-метилбутанала. В настоящей статье представлены результаты исследования свойств трех штаммов дрожжей, используемых на чешских пивзаводах, с точки зрения образования ими диоксида серы и активности редуктаз альдегидов и связи этих факторов с различиями в кривых роста, степени гидрофобности и абсорбции аминокислот. Также был исследовано влияние штамма дрожжей на изменение окислительно-восстановительной способности сусла и изменение концентрации полифеноль-ных соединений в сбраживаемом сусле.
2. Материал, оборудование и метожы
2.1. Моделирование брожения
Эксперименты по моделированию брожения проводились в течение трех лет в 10-литровых бродильных цилиндрах с 10%-ным и 12%-ным светлым суслом (суммарный объем сусла 35 л), которое всякий раз бралось на одном чешском пивзаводе. Примеры приведенных в публикации результатов взяты на основании данных опытных циклов сбраживания 12%-го сусла, для которых были обеспечены абсолютно сходные технологические условия, т.е. одинаковый состав сусла, аэрирование (8,0 мг/02), главное брожение проводилось всегда при температурах 7°С, 10°С и 13°С, одинаково используемые дро-жии и хмель физиологическое состояние и концентрация дрожжей в сусле (10 млн клеток/мл) была одинаковой. Поэтому установленные различия в результатах анализов можно приписать генетическим различиям исследованных штаммов.
2.2. Штаммы дрожжей
Исследовались три штамма дрожжей, которые в коллекции VUPS (Прага) обозначены как: 1) штамм №2 - сбраживание от среднего до глубокого, хорошее оседание, 2) штамм №7 - средне-сбраживающий, очень хорошее оседание, 3) штамм №95 - глубоко-сбраживающий, хорошее оседание.
2.3. Использованные методы
2.3.1. Определение активности 3-метилоутаналредуктазы
Принцип
При переносе водорода кофактором НАДФ возникает ароматический характер его пиримидинового ряда, и в связи с этим характерно меняется абсорбция в УФ-диапазоне.
Оборудование и инструменты
Спектрофотометр Shimadzu UV 2100, кремниевая кювета шириной 1 см.
Дезинтегратор Bio Neb.
Растворы
Смесь Тритон-альдегид: 7,5 мл 0,1 М МЕЗ (2-(М-морфоли-но)этансульфоновая кислота) рН 7,0, 300 мкл Тритон, 100 мкл 3-метилбутанала, 16,8 мл дистиллированной воды, 8,3 мг НАДФ в 1 мл дистиллированной воды, 100 мМ b-сульфанилэтанола.
Подготовка образцов
Из бродильного цилиндра было взято 1000 мл разброженно-го сусла, из которого центрифугированием при 1000 об./мин. была получена часть густых дрожжей. Дрожжи в количестве 1 г ресуспендировались 0,1 М МЕЗ в буферном растворе с рН 7,0, содержавшем 1 мМ р-сульфанилэтанола, 1 мМ фенилметил-сульфонил флуорида и 0,2 мМ сорбитола, и смесь перемешивалась в дезинтеграторе высокого давления. Для дальнейшей работы использовался супернатант, полученный центрифугиро нием в течение 20 минут при 10 000 об./мин.
Рабочий метод
В кремниевую кювету шириной в 1 см с помощью пипетки были помещены: 1,5 мл раствора Тритон-альдегида, 30 мш фактора НАДФ, 30 мкл 100 мМ b-сульфанилэтанола, 1 млд тиллированной воды и 0,5 мл дрожжевого супернатанта.
Ультрафиолетовым спектрофотометром измерялась а сорбция при 340 нм в течение 4 минут.
Расчет и оценка результатов
Итоговая активность 3-метилбутаналредуктазы выражалаись в мкмоль кофактора НАДФ, окисленного в течение часа, в расчете на мг белка, количество которого в дрожжах было определено методом Фолина.
2.3.2. Другие использованные методы
Дрожжевые полисахариды определялись методом экстракции по Тревеляну и Харрисону, гликоген - измерением флюоресценции акрифлавина, гидрофобность клеточных поверхностей - по Хинклиффу и др., окислительно-восстановительная способность сбраживаемого сусла - по Канед, Шапону и МЕВАК, гистограммы размера (РSС) и гранулярности (SSС) - проточным цитометро РАРТЕС-РА8-Ш. Кривая роста, определение диоксида серы дистилляцш определение общих, окисленных, окисляемых полифенолов антоцианогенов, отдельных аминокислот на автоматическо анализаторе Т339 проводилось согласно стандартным опю ным методам.
3. Результаты и обсуждение
Образование дрожжевыми штаммами вторичных метаболи тов и уровень ферментативной активности в процессе броже] ния тесно связаны с генетически обусловленной способное к метаболизму, проявляющейся в скорости и степени размно жения клеток, а также в способности к оседанию. Эти свойствa относятся к наследственным признакам клеточной популяции,
3.1. Различия в кривых роста у исследованных штаммов
Кривая роста для дрожжевого штамма №7 по сравнению с штаммом №2 и №95 отличалась более короткой лаг-фазой, более бурной фазой экспоненциального роста с более ранним, но более низким максимумом количества клеток в фазе роста, более ранней агглютинацией и седиментацией (рис. 1,2). Штаммы №2 и №95 достигли максимума на кривой роста в одно и то же время брожения. У штамма №2 при различных условиях брожения максимум на кривой роста был неизменно выше, а оседание, характеризующееся уменьшением количества клеток в фазе роста, значительнее, чем у штамма №95.
Эти различия в характере кривых роста сравниваемых штаммов соотносятся с различиями гистограмм размера (РSС) и гранулярности (SSС) клеток. Гистограмма отражает зависимость данной величины от количества клеток, прошедших через кювету проточного цитометра за данное время.
На гистограмме размера клеток в течение 72-го часа брожения (рис. 3) у штамма №7 видно появление двух максимумов, тогда как у штамма №2 и №95 пик только один. Это доказывает, что в данное время брожения у штамма №7 присутствовали две субпопуляции. Клетки большего размера, т.е. клетки с почкой, представлены максимумом, лежащим правее на горизонтальной оси. Гистограммы гранулярности отражают свойства клеточных поверхностей, например, неровность поверхности вследствие образования рубцов после почкования. В течение 72-го брожения на гистограмме (рис. 4) самое низкое среднее значение пика можно наблюдать прежде всего для штамма №2, что свидетельствует о меньшем количестве делящихся клеток в данное время по сравнению прежде всего со штаммом №7.
3.2. Различия штаммов дрожжей в отношении гидрофобности клеточных поверхностей
Все дрожжи низового брожения Saccharomyces uvarum в отношении взаимодействия между средой и поверхностью клеток отличаются в принципе гидрофильным характером. Дрожжи верхового брожения Saccharomyces cerevisiae имеют гидрофобные свойства. Индекс гидрофобности НI представляет собой отношение между значениями абсорбции водной и углеводородной фазы с дрожжевой популяцией, измеренное при 660 нм. Для дрожжей верхового брожения НI менее 50%, для «низовых» дрожжей - выше 50%.
Измерение гидрофобности подтвердило, что штаммы №2, №7 и №95 принадлежат к группе гидрофильных микроорганизмов, так как полученные значения НI были больше 50% (рис. 5). Однако оказалось, что и для штаммов низового брожения существует тенденция к адгезии некоторых клеток к пузырькам углекислого газа, а часть дрожжей поднимается после добавки органических веществ (гексана, изооктана, диэтилэфира и т.д.). В этом отношении максимальной тенденцией к гидрофобности отличался штамм №95, что соотносится с его худшей способностью к оседанию по сравнению со штаммом №2 и, прежде всего, со штаммом №7.
3.3. Различия в распаде и синтезе полисахаридов клеточных стенок исследованных штаммов в процессе брожения
Согласно сегодняшним представлениям, способность к флокуляции и оседанию у низовых дрожжей обусловлена генетически. Однако на нее влияют также свойства среды культивирования и метаболическая активность дрожжей. К факторам, влияющим на флокуляцию и оседание дрожжей, а тем самым и на степень их метаболической активности, относятся изменения содержания полисахаридов в клеточных сте ках, прежде всего маннана (рис. 6), в меньшей степенипи кана (рис. 7). Обычно считают, что хуже флокулирующие и оо дающие пылеводные дрожжи имеют в клеточных стенк больше маннана, чем хорошо оседающие дрожжи. Различия содержании маннана в клеточных стенках исследованш штаммов дрожжей и его изменения в процессе брожения были незначительны, что связано с тем, что при одних и тех же условиях способность дрожжей к оседанию не особенно ото чалась (рис. 6). В начале процесса брожения содержание ма нана быстро снизилось, потом последовал его увеличение дальнейшее снижение. Начало флокуляции и оседания соо ветствовало, согласно данным, приводимых в специальной литературе, тому моменту брожения, когда содержание маг нана в клеточных стенках был самым низким. Штамм №7 отличался тем, что у него максимум содержание маннана в клето ных стенках в процессе брожения был достигнут раньше, чем у штаммов №2 и №95. После достижения максимума у штамма №7, наоборот, наблюдалось резкое снижение количестве маннана, тогда как у двух других исследованных штаммов ег количество уменьшалось медленнее. По-видимому, с этим определенной степени связаны также установленные умерен ные различия во времени и скорости оседания штамма №7 сравнению со штаммами №2 и №95.
3.4. Различия в распаде и синтезе клеточных полисахаридов
исследованных штаммов дрожжей в процессе брожения
Основным резервным веществом, которое дрожжевая клетка использует для получения энергии, необходимой (особенно в начале роста) для размножения и метаболической деятельности, является гликоген. Методом экстракции во всех экспериментах для штамма №7 был получен несколько более высокий по сравнению со штаммами №2 и №95 уровень содержания клеточных резервных полисахаридов, в особенности гликогена (рис. 8), а также и дисахарида трегалозы (рис. 9). У всех трех штаммов содержание гликогена в процессе брожения сначала уменьшалось, а потом опять увеличивалось в результате синтеза гликогена клетками. Это было подтверждено и с помощью метода, основанного на принципе измерения флуоресценции акрифлавина, значения которого соответствовали концентрации гликогена в клетках [17] (рис. 10). Штамм №7 в течение первых 48-72 часов брожения проявил тенденцию к более значительному потреблению гликогена, а затем - к более интенсивному его синтезу, что при повторном использовании семенных дрожжей обуславливает более быстрое размножение дрожжей, так как в лаг-фазе в распоряжении клеток имелся богатый источник энергии для синтеза стеринов и жирных кислот.
3.5. Различия в скорости и степени абсорбции аминокислот сусла
Дрожжи абсорбируют аминокислоты сусла постепенно. Отдельные их группы могут быть использованы ими только после снижения до определенного значения содержания потребленных ранее соединений, прежде всего треонина и серина.
Нами уже были опубликованы работы, посвященные различиям штаммов, в том числе штаммов №2 и №7, в отношении абсорбции ими аминокислот сусла. Полученные ранее результаты еще раз подтвердились при исследовании штаммов, о которых идет речь в данной статье. Дрожжи штамма №7, размножающиеся быстрее, отличаются повышенным синтезом тех аминокислот, которые он в необходимый момент еще не могут получить из сусла, прежде всего разветвленных аминокислот, таких как валин. Этим объясняется тенденция к повышенному образованию диацетила у пива, полученного с использованием штамма №7, так как его клетки выделяют в сбраживаемую среду большее количество промежуточных продуктов синтеза валина - а-ацетолактата - по сравнению с другими исследованными штаммами. Выделенный а-ацетолактат неферментативным путем превращается в диацетил.
Уменьшение количества валина на 50% от исходного количества в 12%-ном сусле в процессе брожения при 10°С было характерно для штамма №95 на 40-м часу брожения, для штамма №2 - на 45-м часу и для штамма №7 - на 48-м часу брожения. Для штамма №7 была отмечена более низкая скорость и меньшая степень абсорбции всех аминокислот сусла. В определенной степени это может повлиять на содержание остаточных аминокислот в пиве, полученном с данным штаммом. В процессе пастеризации и хранения для такого пива можно предполагать возникновение большего количества так называемых компонентов старого вкуса пива типа альдегидов, образующихся после распада аминокислот.
3.6. Различия в процессе образования диоксида серы в процессе брожения
Образование диоксида серы зависит от ряда факторов, влияющих на рост и физиологическое состояние дрожжей. Решающее влияние штамма дрожжей уже было нами доказано ранее. Максимальное образование S02 было характерно для всех трех штаммов по достижении максимума кривой роста (рис. 11). Затем следовало плавное снижение, обусловленное, с одной стороны, взаимодействием с карбонильными соединениями, с другой - возможным вместе с углекислым газом в бродильные газы.
Не существует единой точки зрения на влияние температуры брожения на образование диоксида серы [40, 41]. Ушида и Оно [42] считают, что влияние температуры проявляется по-разному в зависимости от штамма и от физиологического состояния дрожжей. Согласно Канеде и др. образование S02 уменьшается с увеличением температуры брожения, тогда как Нордлов [40] утверждает, что оптимальная температура брожения для образования S02 колеблется между 14° и 16°С. Применение давления в начале процесса брожения подавляет рост дрожжей и ускоряет образование S02.
В более ранних и данных исследованиях нами был установлено, что с увеличением температуры брожения (исследования проводились при температуре 7°С, 10°С, 13°С, 18°С) у всех трех штаммов - №2, №7 и №95 - увеличивался максимум образования S02, но более интенсивным было и последующее его снижение, как это видно на примере брожения со штаммом №2 при двух температурах (рис. 12).
В отличие от других авторов, утверждающих, что при более высокой концентрации семенных дрожжей образование S02 несколько увеличивалось, мы ни у одного из исследоЕ нами штаммов не отметили видимого различия при концентрации дрожжей от 10 до 25 миллионов клеток на мл (рис. 13)
На образование S02 значительно влияет физиологии состояние дрожжей. Голодание или старение дрожжей перед введением в сусло увеличивает образование S02. В про старения клеток снижается уровень гликогена в клетках, релл и др. установили, что существует зависимость его содержанием в семенных дрожжах и уровнем S02 к брожения. Факторы, способствующие исчерпанию запасо когена, например, повышение температуры или срока хранения семенных дрожжей, приводят к увеличению образования S02.
При разных условиях брожения наибольшее интена образование S02 был характерен для штамма №2, неш менее интенсивное - для штамма №95 и самое слабое - штамма №7, которому была свойственна тенденция к бол му содержанию гликогена в клетках.
Так как во всех экспериментах сравнивались штаммы с наковым физиологическим состоянием, различия в образов S02 можно приписать разным генетическим свойствам исследованных штаммов дрожжей в отношении использование серы.
Диоксиды серы являются промежуточными веществами при превращении серы до серосодержащих аминокислот тионина и цистеина. Источниками серы для дрожжевой кл являются неорганические сульфаты, поставляемые в кл пермеазой и превращающиеся с помощью АТР-сульфури; (АТР, ЕС 2.7.7.4) в аденилсульфат (АРS), а далее при учаcnbb АРS-киназы на фосфоаденилсульфат (РАРS), который в с очередь превращается под воздействием диоксида серы РАРS-редуктазы. Под действием сульфитредуктазы (S-R, ЕС 1.8.9 диоксид серы восстанавливается до сульфда, использую гося дрожжами при синтезе цистеина, метионина и S-аденносилметионина (SАМ). Последнему присуща транскрипция бс шинства генов, если не всех, отвечающих за использование ры. Способ использования серы запрограммирован ме болически и генетически. Из этого следует, что выделее дрожжами сульфитов может быть вызвано несбалансировансированностью образования и потребления диоксида серы или его вз; модействием с другими соединениями. Их накопление вдрс жевой клетке может привести к проникновению свободной связанного диоксида серы через цитоплазматическую мембрану в сбраживаемое сусло. Брюер и Фентон установили, что в момент максимального образования SO2 отношение активности АРS и сульфитредуктазы в три-шесть раз ниже у штаммов с низким образованием SO2, чем у штаммов с высоким образованием SO2. Другой причиной снижения количества сульфитов является образование соединений с ацетальдегидом. Вследствие этого возникает недостаток метионина и активируется абсорбция и восстановление сульфата [39]. Активно сбраживающая дрожжевая клетка выделяет сульфиты. Это выделение прекращается в конце брожения, когда исчерпываются источники энергии для изменения сульфата. В начале брожения выделение сульфитов начинается после лаг-фазы и быстро увеличивается до тех пор, пока метионин из среды не будет исчерпан почти полностью. Самое значительное увеличение происходит между лаг-фазой и концом брожения. Пока продолжается размножение дрожжей, высока потребность в серосодержащих аминокислотах, а выделение сульфитов остается на низком уровне. Как только размножение дрожжей заканчивается, первая часть цепочки, которая ведет к превращению сульфата в диоксид серы, все еще активна, тогда как снижение потребности в серосодержащих аминокислотах и более низкая активность сульфитредуктазы способствуют накоплению и выделению S02, пока присутствует сбраживаемый экстракт. Поэтому в среду попадает тем больше сульфитов, чем больше экстракта сброжено после окончания фазы размножения.
Штамм №7 из-за бурного размножения клеточной популяции в экспоненциальной фазе исчерпывает энергетический потенциал, и после достижения максимума кривой роста агглютинируется и осаждается раньше, чем штаммы №2 и №95. Поэтому в этой фазе он не способен в той же степени сбраживать оставшийся экстракт, и образование SO2 у него ниже. Кроме того, у исследованных штаммов, по-видимому, будут несколько отличаться и генетические характеристики, ответственные за инициацию соответствующих ферментов в метаболизме серосодержащих соединений, что подробно описано, например, в печатной версии дипломной работы, сделанной в Химико-технологическом институте.
3.7. Различия в активности 3-метилбутаналредуктазы дрожжевых штаммов в процессе брожения
Фермент 3-метилбутаналредуктаза позволяет популяции дрожжей восстанавливать альдегиды. При одной и той же температуре брожения самую высокую активность фермента 3-метилбутаналредуктазы проявил штамм №2, самую низкую -штамм №7 (рис. 14). Эта активность достигала своего максимума в фазе экспоненциального роста дрожжевых клеток, потом отмечалось постепенное снижение. На примере сбраживания штаммом №2 видно, что активность редуктазы увеличилась при температуре брожения 13°С по сравнению с брожением при температуре 10°С, но последующее снижение в результате более быстрого ингибирования ферментативной активности было более значительным (рис. 15). При температуре брожения 7°С различия в активности 3-метилбутаналредуктазы у всех трех штаммов были незначительны в процессе всего брожения, активность в целом была ниже, но тенденции к ее увеличению и снижению сохранялись.
3.8. Влияние штамма дрожжей на изменение окислительно-восстановительной способности сбраживаемого сусла
Показатель оксилительно-восстановительной способности характеризует состояние сусла или пива с точки зрения его устойчивости к окислительным изменениям некоторых веществ экстракта. Он указывает на то или иное отношение соединений в окисленной и восстановленной форме соответствующих обратимых реакций. Шапон и Крецчмер показали, что существует определенная связь между восстановительной способностью и коллоидной и сенсорной стабильностью пива. Ушида и Оно считают, что сенсорная стабильность пива определяется эндогенной антиоксидантной способностью, на которую влияет каждый этап пивоваренного процесса, начиная от сырья и кончая розливом пива. Результаты определения окислительно-восстановительного потенциала сусла, параллельно сбраживаемого штаммами №2, №7 и №95, по методам Канеды, Шапо-на и МЕВАK, каждый из которых регистрирует разные группы веществ, не показали влияния штамма дрожжей на данный показатель ( рис. 16,17,18). Не было установлено и значительного влияния температуры брожения. Рост окислительно-восстановительной способности в течение первых 28 ч брожения связан с ростом биомассы и потреблением растворимого кислорода суслом.
Полученные результаты показали, что решающее влияние на окислительно-восстановительные свойства пива оказывает доля соединений в восстановленной форме, по происхождению связанных с сырьем, т.е. солодом и хмелем, и их изменения, вызванные условиями технологического процесса.
3.9. Изменения полифенолов в процессе экспериментального брожения
В физико-химических и сенсорных свойствах пива полифе-нольные соединения играют как значительную положительную, так и отрицательную роль. Окисленные полифенолы в результате различных реакций способствуют образованию коллоидных осадков, а также «старого» вкуса пива. Напротив, восстановленные формы способствуют длительному сохранению прозрачности и «свежему» вкусу пива.
Выпадение из раствора нестабильных, прежде всего окисленных полифенолов и их удаление в процессе охлаждения сусла и сбраживания является одной из предпосылок повышения устойчивости пива к образованию коллоидных осадков и к сенсорным изменениям. Процесс осветления в значительной степени зависит от изменений рН и окислительно-восстановительной способности сбраживаемой среды. Эти факторы, наряду с технологическими условиями, также зависит от свойств использованного штамма дрожжей.
На основе проведенных опытных циклов брожения можно судить о влиянии температуры на снижение содержания с полифенолов. При более высокой средней температуре ного брожения наблюдался более значительное снижем держания общих полифенолов. Тот же вывод можно еде; для снижения содержания окисленных полифенолов в пр се брожения. Снижение содержания окисленных полифе при температуре брожения 13°С достигало около 80% от и центрации в исходном сусле. Не подтвердилось влияние пературы брожения на изменения окисляемых полифен Не было установлено существенного различия в отншении снижения содержания исследованных групп полифенольных соединений при сбраживании штаммами №2, №7 и №9 одних и тех же технологических условиях, что говорит о то особенности использованного штамма дрожжей не играю чительной роли в процессе снижения уровня полифенольных соединений в процессе брожения.
4. Выводы
Правильный выбор штамма дрожжей и его физиолс ское состояние влияют не только на плавность протекани нологического процесса и достижение основных химичес биохимических показателей и типичного букета данного пива, но могут также замедлить образование коллоидных осадков и сенсорных изменений продукта в процессе его хранения.
www.propivo.ru
На предыдущую
lautertun.narod.ru
 |  |  |  |  |  |  |  |  |  |  |  |  |  |  |
 Пример видео 3 Пример видео 3 |  Пример видео 2 Пример видео 2 |  Пример видео 6 Пример видео 6 |  Пример видео 1 Пример видео 1 |  Пример видео 5 Пример видео 5 |  Пример видео 4 Пример видео 4 |
Администрация муниципального образования «Городское поселение – г.Осташков»






















