Штамм saccharomyces cerevisiae для получения биомассы хлебопекарных дрожжей. Спиртовые дрожжи saccharomyces cerevisiae
ШТАММ ДРОЖЖЕЙ Saccharomyces cerevisiae, ИСПОЛЬЗУЕМЫЙ ДЛЯ ПОЛУЧЕНИЯ СПИРТА
Изобретение относится к спиртовой промышленности и представляет собой новый штамм дрожжей Saccharomyces cerevisiae В - 3855, используемый для производства спирта.
В производстве спирта из мелассы дрожжи должны обладать высокой бродильной энергией с анаэробным типом дыхания, переносить большую концентрацию солей и сухих веществ, быть устойчивыми к продуктам обмена посторонних микроорганизмов.
В производстве спирта из мелассы применяются различные штаммы дрожжей Saccharomyces cerevisiae и среди них наиболее распространенной является производственная раса Я, с хорошими технологическими свойствами [1, 2] - аналог. Однако, эта раса имеет сравнительно невысокую генеративную активность, обладает повышенной потребностью к стимуляторам роста, чувствительностью к вредным примесям мелассной среды. В морфологическом отношении штамм неоднороден по величине и форме, с наличием в популяции удлиненных клеток, имеющих замедленную скорость роста, более длительное время генерации по сравнению с овальными клетками.
Известно также, что традиционной средой для выращивания дрожжей S. cerevisiae, используемых в спиртовой промышленности является мелассная питательная среда. Создание современных прогрессивных технологий пищевого спирта диктует необходимость получения физиологически активных рас дрожжей, обеспечивающих эффективное сбраживание концентрированного мелассного сусла. Нами установлено, что минеральные и органические вещества геотермальной воды нефенольного класса можно рассматривать как новый источник питания дрожжей. Установлено также, что интенсификация синтеза этанола на 25% и значительное снижение весьма нежелательных примесных соединений с использованием штамма S. cerevisiae Y-503 обусловлены возможностью изменения метаболизма дрожжей на основе влияния биологически активных веществ геотермальной воды [3, 4]. В связи с этим, новый штамм получают на мелассной питательной среде, где в качестве минерального и органического питания используют геотермальную воду нефенольного класса с общей минерализацией 5.2-5.4 г/л, разбавленную водопроводной водой до минерализации 4.0-5.2 г/л. Наличие таких важных минеральных веществ, необходимых для жизнедеятельности живых организмов, как K, Na, Mg, Ca, Fe, Mn, а также борная, кремниевая кислоты, органические вещества, в частности, гумусовые, являющиеся стимуляторами мембранных перестроек в живой клетке, создают благоприятные условия в среде культивирования для выращивания дрожжевых организмов.
Задачей изобретения является создание стабильного штамма спиртовых дрожжей для эффективного сбраживания мелассной питательной среды с использованием геотермальной воды нефенольного класса с концентрацией углеводов 21.0 г / 100 см3, способного сохранять спиртоустойчивость, высокие биохимические и технологические свойства в результате селекции при длительном пассажировании его на твердых и жидких средах. Технический результат направлен на повышение выхода спирта.
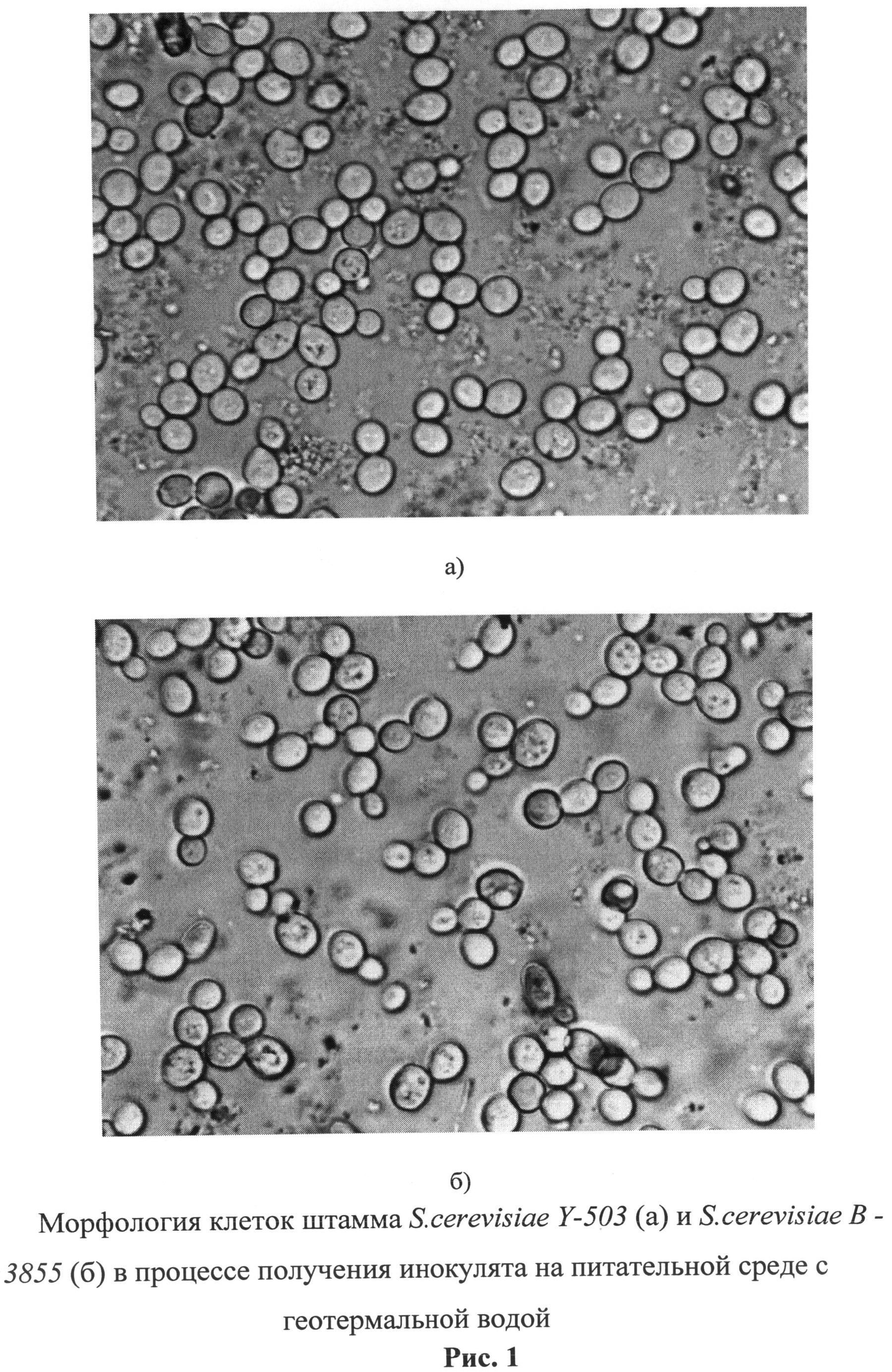
Предлагаемый штамм дрожжей имеет следующую характеристику. Морфолого-культуральные признаки. Клетки в суточной культуре на мелассной питательной среде с геотермальной водой (МПСГВ) имеют округло-овальную форму, размером 6-8×11-13 мкм; на МПСГВ + агар - овальная, яйцевидная, размером 6-7×11-12 мкм. Культура размножается вегетативным путем, образует сумки со спорами (среда Городковой, гипсовые блоки, голодный агар). Микроколонии на МПСГВ + агар - округлые, гладкие, слегка блестящие с ровным краем, размером 4-7 мм, палевого цвета. Макроколонии (20-ти суточная)- округлой формы, размером 2.9×2.7 см, поверхность радиально исчерченная с концентрическими кругами, слегка блестящая, светло-палевая, край волнистый, профиль слегка выпуклый с небольшими конусом, структура однородная, консистенция мажущаяся (рис.1,2).
Физиолого-биохимические признаки. Штамм S. cerevisiae В - 3855 полностью сбраживает: глюкозу, фруктозу, сахарозу, лактозу, мальтозу, раффинозу, простые декстрины; не сбраживает и не усваивает лактозу и инулин. Усваивает уксусную, молочную, не усваивает янтарную, яблочную, винную, лимонную кислоты [5]. Сбраживает высококонцентрированные рассиропки с содержанием углеводов 21.0 г / 100 см3, синтезируя 12.4 об.% спирта. Оптимальная температура роста 20-30°С, однако может расти и при температуре 32-33°С. Оптимальными значениями рН среды являются 4.5-5.5.
Предлагаемый штамм S. cerevisiae В - 3855 хранится в ВКПМ ГНИИгенетика под коллекционным номером В - 3855 и в дрожжевой коллекции Прикаспийского института биологических ресурсов Дагестанского научного центра РАН г.Махачкала. Пример получения штамма.
Исходной культурой для получения штамма S. cerevisiae В - 3855 служил штамм S. cerevisiae Y-503 [4]. Для получения дрожжей с требуемыми свойствами была проведена адаптация штамма S.cerevisiae Y-503 к мелассной питательной среде с геотермальной среднеминерализованной, сульфатно-хлоридно-гидрокарбонатной натриевой водой из скважины №26 Махачкалинского месторождения. По мере воздействия состава питательной среды микроорганизмы адекватно изменились, что привело к возникновению новых форм. При этом немаловажное значение имела и частота пересевов на свежие среды.
На первом этапе исследований из отдельных многочисленных микроколоний (95), путем поиска полезных морфофизиологических свойств был проведен скрининг активных популяций исследуемых рас. В результате было выделено 6 монокультур путем рассева отобранных клонов на питательные среды с повышенной концентрацией сухих веществ. Наблюдения за динамикой брожения всех культур выявили идентичность выделения углекислого газа в течении первых 24 ч после инокуляции. Значительный рост бродильной активности проявился на 3-8-е сутки, который в большей мере отмечен у 3-х вариантов. На втором этапе адаптированную дрожжевую суспензию высевали на плотную мелассную питательную среду с геотермальной водой. Каждая выросшая колония отсевалась на скошенное агаризированное мелассное сусло. На всех этапах исследования осуществлялся контроль за функциональной морфологией дрожжевых клеток. Наблюдения велись за скоростью и характером почкования, ростом, размножением, формой и величиной клеток. Из них наибольшей бродильной способностью, лучшими морфофизиологическими свойствами обладала культура В - 3855. Концентрация этанола в бражке увеличилась и составила 12.4 об %. Сравнительное исследование динамики сбраживания мелассного сусла с концентрацией углеводов 21.0 г / 100 см3 селекционным штаммом В - 3855, исходным Y-503 и промышленным - Я, показали перспективность использования отобранного штамма.
Предлагаемый штамм хранится на скошенном МПСГВ+агар в холодильнике при температуре 0±6°С.
Пример использования штамма.
Выращивание дрожжей с использованием предлагаемого штамма S. cerevisiae В - 3855 осуществляют в течение 72 ч глубинным методом в периодическом режиме в анаэробных условиях в лабораторной установке при температуре 30°С±1, рН 5.0 на мелассной питательной среде с геотермальной водой (МПСГВ) и содержанием углеводов 21.0 г / 100 см3 следующего состава (г/л):
- меласса 488.74
- гидроортофосфат аммония 2.58
- геотермальная вода с минерализацией 4.0-4.2 г/л с определенным качественным и количественным составом необходимым для выращивания дрожжей остальное
К мелассе добавляют разбавленную водопроводной водой геотермальную воду до содержания в среде углеводов 21.0 г/100 см3, гидроортофосфат аммония - 2.58 г/л, концентрированную серную кислоту, для достижения в среде рН 5.0, из расчета 0.4-0.6 мл на 100 г мелассы. Содержимое хорошо перемешивают. Стерильную питательную среду разливают по 1.5 л. в сосуды вместимостью 3 л., затем засевают вегетативной культурой указанного штамма в количестве 150 мл. из дрожжевой суспензии последней стадии адаптации на МПСГВ, 1 мл которой содержится 95.6 млн/мл клеток. В качестве пеногасителя используют структол 0.1 мл/1.5 л среды. По окончании 72-х часового эксперимента дрожжи отделяют от культуральной жидкости центрифугированием (5000g, 15 мин) на лабораторной стационарной центрифуге ЦЛС-344.2. По завершению эксперимента в сброженном субстрате определены остаточный сахар, накопление спирта и содержание примесных соединений. Наибольшее количество спирта отмечено в образце S. cerevisiae В - 3855 при минимальном содержании остаточного сахара (табл.1).
Усвоение раффинозы данной культурой (предлагаемый штамм) происходит в большей степени, чем исходным S. cerevisiae Y-503 и производственной расой Я (на 1/3), что обусловлено активацией фермента α-галактозидазы, катализирующего сбраживание этого углевода. Видимо, органические компоненты геотермальной воды (гуминовые кислоты), влияя на коллоиднохимические свойства протоплазмы и эффективность использования клеткой из питательной среды биологически активных веществ, усиливают тем самым ферментативную активность живой клетки.
Установлено, что опытный вариант имеет более высокий уровень активности β-фруктофуранозидазы, который проявляется с первых минут брожения. Обнаружено, что уровень активности альдолазы у штамма S. cerevisiae В - 3855 превышает показатели исходного и контрольного на 6 и 25% соответственно. Ключевым веществом анаэробного расщепления глюкозы и метаболизма Сахаров является пировиноградная кислота, разложение которой на ацетальдегид и СО2 катализируется пируватдекарбоксилазой. Полученные данные позволяют говорить о более высокой активности фермента в опытной живой биомассе на 27 и 37% по сравнению с исходной культурой и контролем. Заключительный этап брожения катализирует алкогольдегидрогеназа, восстанавливающая ацетальдегид до этанола. Активность данного фермента в клетках опытного варианта S. cerevisiae В - 3855 намного превышает данный показатель у исходного и контрольного (табл.2).
Анализ хроматограмм летучих примесей выявил идентичный качественный состав, причем штамм S. cerevisiae В - 3855 отличался количеством синтезируемых побочных метаболитов - 30.18% меньше по сравнению с S. cerevisiae Y-503, что является результатом изменения регуляторных функций клетки (табл.3). Так, S. cerevisiae В - 3855 синтезирует ацетальдегида почти вдвое меньше, чем штамм S. cerevisiae Y-503. Ацетон (на 29.16% меньше в опыте) может служить необходимым продуктом для образования высших спиртов, что нежелательно для получения основного продукта - этанола. С использованием культуры S. cerevisiae В - 3855 спирты: пропанол-1, изобутанол, бутанол-1, изоамилол и гексанол обнаружены в значительно меньшем количестве по сравнению со штаммом Y-503 (8518.24:10947.20 мг/дм3, опыт: исходный). В большей степени присутствие пропанола-1 и изоамилола в контроле на 30 и 14%, соответственно, ухудшает технологическую характеристику субстрата с приобретенным сивушным запахом. Увеличение концентрации кротональдегида, как сильного лакриматора, в контроле на 40% сообщает горечь, ухудшает пробу спирта на окисляемость. Содержание фенилалкоголя и бензальдегида - гликозида с запахом горького миндаля, превышает пороговые концентрации в субстратах, но с использованием культуры S. cerevisiae В - 3855 они меньше на 19.5% и 32.9% соответственно. Очевидно, положительные результаты исследований обусловлены биохимическими изменениями в клетке в результате проведенной адаптации и селекции к соответствующим условиям культивирования.
Таким образом, использование штамма дрожжей S.cerevisiae В - 3855, способного сбраживать мелассное сусло с концентрацией углеводов 21.0 г/100 см3, позволит интенсифицировать технологический процесс получения спирта до 12.4 об.%, снизить на 30% образование побочных метаболитов.
Библиография
1. Маринченко В.А., Метюгиев Б.Д., Щвец В.Н. Технология спирта из мелассы // Издательское объединение «Вища школа», Киев. 1975. С.75-153.
2. Микелов А.Н., Соболев Э.М., Боярский В.М. Бродильная способность рас дрожжей // Известия вузов. Пищ. технол. 1995. №5, 6. С.14-16.
3. Патент РФ №2329302 Способ сбраживания мелассного сусла / Ш.А.Абрамов, Э.А.Халилова // Б.И. 2008. №20.
4. А.с СССР №1284998 Штамм дрожжей Saccharomyces cerevisiae Y-503, используемый в производстве хлебобулочных изделий / Ш.А.Абрамов, С.Ц.Котенко, Б.И.Далгатова, А.Т.Маммаев // Б.И. 1986, №3.
5. Кудрявцев В.И. Систематика дрожжей. М.: Из-во АНСССР.1954, 212 с.

|
|

edrid.ru
Штамм saccharomyces cerevisiae для получения спирта и биомассы хлебопекарных дрожжей
Изобретение относится к микробиологической, спиртовой и дрожжевой промышленности. Отселекционирован штамм Saccharomyces cerevisiae Y2283 для производства спирта и биомассы хлебопекарных дрожжей из крахмалсодержащего сырья. Штамм характеризуется высокой глюкоамилазной активностью ( 1-1,25 ед/мл), что позволяет исключить использование глюкоамилазы в процессе осахаривания крахмалсодержащего сырья при производстве спирта и биомассы хлебопекарных дрожжей.
Изобретение относится к микробиологической, спиртовой и дрожжевой промышленности.
В настоящее время для производства спирта из крахмалсодержащего сырья используется термотолерантный штамм дрожжей Saccharomyces cerevisiae Y1986, обладающий глюкоамилазной активностью. Использование этого штамма дрожжей недостаточно обеспечивает сокращение осахаривающих средств, необходимых для гидролиза растительного крахмала в спиртовом производстве (1). Недостатком этого штамма является малоэффективная продукция эндогенной глюкоамилазы. Целью данного изобретения является создание штамма термотолерантных дрожжей с высокой глюкоамилазной активностью, способного проводить осахаривание крахмала в процессе роста и позволяющего исключить внесение глюкоамилазы, необходимой для осахаривания крахмала, используемого при производстве спирта, а также биомассы хлебопекарных дрожжей. Штамм Saccharomyces cerevisiae Y2283 получен в результате снятия углеродной катаболитной репрессии гена глюкоамилазы. Проведена селекция клонов на максимальную продукцию фермента глюкоамилазы и исключено внесение дорогостоящего компонента - глюкоамилазы для осахаривания крахмала при производстве спирта и биомассы хлебопекарных дрожжей. Штамм депонирован во Всесоюзной коллекции промышленных микроорганизмов (ВКПМ) под номером Y2283. Штамм характеризуется следующими культурально-морфологическими и физиолого-биохимическими признаками. Вегетативные клетки двухсуточной культуры, выращенной на твердой питательной среде с 2% крахмала в качестве единственного источника углерода, имеют вытянутую, реже округлую форму, размер клеток 3,0 х 6,5 мкм, протоплазма гомогенная, размножение почкованием. При выращивании на твердой среде, содержащей дрожжевой экстракт и пептон, (YEP) при 30oC через 72 ч роста колонии имеют следующий вид: 1) на среде YEP с глюкозой колонии белого цвета с ровным краем, блестящей поверхностью, конусообразным профилем, сметанообразной консистенцией; 2) на среде YEP с крахмалом колонии белого цвета с ровным краем, матовой поверхностью, линзовидным профилем и крупинчатой консистенцией; 3) на среде YEP с крахмалом и галактозой колонии белого цвета с матовой поверхностью, ровным краем, выпуклым профилем и крупинчатой консистенцией. Рост в жидкой среде. На солодовом сусле при 35oC в течение первых 24 ч культивирования - жидкость мутная, осадок белый, не комкуется, пристеночной пленки не образует, запах этанола. На среде YEP, содержащей 3% крахмала, в течение 20 ч культивирования - жидкость мутная, характерный запах дрожжей. Факультативный аэроб. Температура роста - 23 - 37oC (оптимум - 32oC). Значения pH при культивировании - 3,8 - 6,7 (оптимум - 5,0). Ассимиляция источников углерода: сбраживает глюкозу, галактозу, фруктозу, мальтозу, сахарозу, декстрины, крахмал. Ассимиляция источников азота: усваивает аминокислоты, мочевину, сернокислый аммоний, азотнокислый аммоний. Отличительные особенности: при культивировании на твердой среде YEP с крахмалом (2%) и галактозой (2%) вокруг колоний образуются ясные зоны просветления крахмала после инкубации чашек при +4oC в течение 24 ч. Штамм Saccharomyces cerevisiae Y2283 непатогенен. Штамм хранится на агаризованной богатой среде с крахмалом в течение 4 месяцев при +4oC. Примеры использования по назначению. Пример 1. Питательной средой является нефильтрованное зерновое ржаное сусло с концентрацией сухих веществ 16%, которое готовится из помола ржи с последующим развариванием при 1,5 атм в течение 1,5 ч. Сусло осахаривают при 56oC в течение 60 мин, добавляя в него фермент амилосубтилин из расчета 0,5 ед. на 1 г условного крахмала. Глюкоамилазу не добавляют. В осахаренное таким образом ржаное сусло засевают клетки штаммов Y1986 и Y2283 в титре 1 107 и проводят процесс брожения при 37oC в течение 72 ч. Во время брожения происходит доосахаривание крахмала ржаного сусла глюкоамилазой, продуцируемой дрожжевыми клетками. Глюкоамилазная активность через 60 часов у штамма Y2283 составляет 1-1,25 ед/мл, в то время как у штамма Y1986 только 0,2-0,25 ед/мл (2). Через 72 часа содержание растворимых несброженных углеводов составляет: у штамма Y1986 - 2,2 г/100 мл, у Y2283 - 0,7 г/100 мл. Пример 2. Питательной средой является жидкая среда YEP, содержащая 3% крахмала. Ферменты не добавляют. Клетки штаммов Y2283 и Y1986 засевают в титре 5
107 и проводят процесс брожения при 37oC в течение 72 ч. Во время брожения происходит доосахаривание крахмала ржаного сусла глюкоамилазой, продуцируемой дрожжевыми клетками. Глюкоамилазная активность через 60 часов у штамма Y2283 составляет 1-1,25 ед/мл, в то время как у штамма Y1986 только 0,2-0,25 ед/мл (2). Через 72 часа содержание растворимых несброженных углеводов составляет: у штамма Y1986 - 2,2 г/100 мл, у Y2283 - 0,7 г/100 мл. Пример 2. Питательной средой является жидкая среда YEP, содержащая 3% крахмала. Ферменты не добавляют. Клетки штаммов Y2283 и Y1986 засевают в титре 5  106 и выращивают на ферментере при 30oC; pH 4,8; pO2 40%. Через 20 часов после начала культивирования титр клеток штамма Y2283 составляет 4
106 и выращивают на ферментере при 30oC; pH 4,8; pO2 40%. Через 20 часов после начала культивирования титр клеток штамма Y2283 составляет 4  108, а у штамма Y1986 значительно ниже и составляет 5
108, а у штамма Y1986 значительно ниже и составляет 5  107 клеток в 1 мл среды. Штамм Y2283 утилизирует до 90% крахмала с коэффициентом конверсии 45%. Таким образом, предлагаемый штамм Y2283 позволяет исключить использование глюкоамилазы при производстве спирта и биомассы хлебопекарных дрожжей на крахмалсодержащем сырье без снижения их выхода, а при производстве биомассы даже увеличивает его. Источники информации 1. Патент РФ N 2001097 C1, C 12 N 1/16, 1993. 2. Препараты ферментные. ГОСТ 20264.4-74. Издательство стандартов, 1975.
107 клеток в 1 мл среды. Штамм Y2283 утилизирует до 90% крахмала с коэффициентом конверсии 45%. Таким образом, предлагаемый штамм Y2283 позволяет исключить использование глюкоамилазы при производстве спирта и биомассы хлебопекарных дрожжей на крахмалсодержащем сырье без снижения их выхода, а при производстве биомассы даже увеличивает его. Источники информации 1. Патент РФ N 2001097 C1, C 12 N 1/16, 1993. 2. Препараты ферментные. ГОСТ 20264.4-74. Издательство стандартов, 1975.Формула изобретения
Штамм Saccharomyces cerevisiae ВКПМ Y 2283 для получения спирта и биомассы хлебопекарных дрожжей.NF4A Восстановление действия патента Российской Федерации на изобретение
Номер и год публикации бюллетеня: 35-2003
Извещение опубликовано: 20.12.2003
www.findpatent.ru
Штамм дрожжей saccharomyces cerevisiae, используемый для получения спирта
Изобретение относится к биотехнологии. Штамм Saccharomyces cerevisiae №8 Спиртовой (8-С), обладающий высокой генеративной активностью, депонирован во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) под регистрационным номером ВКПМ В-3855 и может быть использован при производстве спирта. Изобретение позволяет повысить выход спирта и снизить образование побочных продуктов. 3 табл., 2 ил.
Изобретение относится к спиртовой промышленности и представляет собой новый штамм дрожжей Saccharomyces cerevisiae В - 3855, используемый для производства спирта.
В производстве спирта из мелассы дрожжи должны обладать высокой бродильной энергией с анаэробным типом дыхания, переносить большую концентрацию солей и сухих веществ, быть устойчивыми к продуктам обмена посторонних микроорганизмов.
В производстве спирта из мелассы применяются различные штаммы дрожжей Saccharomyces cerevisiae и среди них наиболее распространенной является производственная раса Я, с хорошими технологическими свойствами [1, 2] - аналог. Однако, эта раса имеет сравнительно невысокую генеративную активность, обладает повышенной потребностью к стимуляторам роста, чувствительностью к вредным примесям мелассной среды. В морфологическом отношении штамм неоднороден по величине и форме, с наличием в популяции удлиненных клеток, имеющих замедленную скорость роста, более длительное время генерации по сравнению с овальными клетками.
Известно также, что традиционной средой для выращивания дрожжей S. cerevisiae, используемых в спиртовой промышленности является мелассная питательная среда. Создание современных прогрессивных технологий пищевого спирта диктует необходимость получения физиологически активных рас дрожжей, обеспечивающих эффективное сбраживание концентрированного мелассного сусла. Нами установлено, что минеральные и органические вещества геотермальной воды нефенольного класса можно рассматривать как новый источник питания дрожжей. Установлено также, что интенсификация синтеза этанола на 25% и значительное снижение весьма нежелательных примесных соединений с использованием штамма S. cerevisiae Y-503 обусловлены возможностью изменения метаболизма дрожжей на основе влияния биологически активных веществ геотермальной воды [3, 4]. В связи с этим, новый штамм получают на мелассной питательной среде, где в качестве минерального и органического питания используют геотермальную воду нефенольного класса с общей минерализацией 5.2-5.4 г/л, разбавленную водопроводной водой до минерализации 4.0-5.2 г/л. Наличие таких важных минеральных веществ, необходимых для жизнедеятельности живых организмов, как K, Na, Mg, Ca, Fe, Mn, а также борная, кремниевая кислоты, органические вещества, в частности, гумусовые, являющиеся стимуляторами мембранных перестроек в живой клетке, создают благоприятные условия в среде культивирования для выращивания дрожжевых организмов.
Задачей изобретения является создание стабильного штамма спиртовых дрожжей для эффективного сбраживания мелассной питательной среды с использованием геотермальной воды нефенольного класса с концентрацией углеводов 21.0 г / 100 см3, способного сохранять спиртоустойчивость, высокие биохимические и технологические свойства в результате селекции при длительном пассажировании его на твердых и жидких средах. Технический результат направлен на повышение выхода спирта.
Предлагаемый штамм дрожжей имеет следующую характеристику. Морфолого-культуральные признаки. Клетки в суточной культуре на мелассной питательной среде с геотермальной водой (МПСГВ) имеют округло-овальную форму, размером 6-8×11-13 мкм; на МПСГВ + агар - овальная, яйцевидная, размером 6-7×11-12 мкм. Культура размножается вегетативным путем, образует сумки со спорами (среда Городковой, гипсовые блоки, голодный агар). Микроколонии на МПСГВ + агар - округлые, гладкие, слегка блестящие с ровным краем, размером 4-7 мм, палевого цвета. Макроколонии (20-ти суточная)- округлой формы, размером 2.9×2.7 см, поверхность радиально исчерченная с концентрическими кругами, слегка блестящая, светло-палевая, край волнистый, профиль слегка выпуклый с небольшими конусом, структура однородная, консистенция мажущаяся (рис.1,2).
Физиолого-биохимические признаки. Штамм S. cerevisiae В - 3855 полностью сбраживает: глюкозу, фруктозу, сахарозу, лактозу, мальтозу, раффинозу, простые декстрины; не сбраживает и не усваивает лактозу и инулин. Усваивает уксусную, молочную, не усваивает янтарную, яблочную, винную, лимонную кислоты [5]. Сбраживает высококонцентрированные рассиропки с содержанием углеводов 21.0 г / 100 см3, синтезируя 12.4 об.% спирта. Оптимальная температура роста 20-30°С, однако может расти и при температуре 32-33°С. Оптимальными значениями рН среды являются 4.5-5.5.
Предлагаемый штамм S. cerevisiae В - 3855 хранится в ВКПМ ГНИИгенетика под коллекционным номером В - 3855 и в дрожжевой коллекции Прикаспийского института биологических ресурсов Дагестанского научного центра РАН г.Махачкала. Пример получения штамма.
Исходной культурой для получения штамма S. cerevisiae В - 3855 служил штамм S. cerevisiae Y-503 [4]. Для получения дрожжей с требуемыми свойствами была проведена адаптация штамма S.cerevisiae Y-503 к мелассной питательной среде с геотермальной среднеминерализованной, сульфатно-хлоридно-гидрокарбонатной натриевой водой из скважины №26 Махачкалинского месторождения. По мере воздействия состава питательной среды микроорганизмы адекватно изменились, что привело к возникновению новых форм. При этом немаловажное значение имела и частота пересевов на свежие среды.
На первом этапе исследований из отдельных многочисленных микроколоний (95), путем поиска полезных морфофизиологических свойств был проведен скрининг активных популяций исследуемых рас. В результате было выделено 6 монокультур путем рассева отобранных клонов на питательные среды с повышенной концентрацией сухих веществ. Наблюдения за динамикой брожения всех культур выявили идентичность выделения углекислого газа в течении первых 24 ч после инокуляции. Значительный рост бродильной активности проявился на 3-8-е сутки, который в большей мере отмечен у 3-х вариантов. На втором этапе адаптированную дрожжевую суспензию высевали на плотную мелассную питательную среду с геотермальной водой. Каждая выросшая колония отсевалась на скошенное агаризированное мелассное сусло. На всех этапах исследования осуществлялся контроль за функциональной морфологией дрожжевых клеток. Наблюдения велись за скоростью и характером почкования, ростом, размножением, формой и величиной клеток. Из них наибольшей бродильной способностью, лучшими морфофизиологическими свойствами обладала культура В - 3855. Концентрация этанола в бражке увеличилась и составила 12.4 об %. Сравнительное исследование динамики сбраживания мелассного сусла с концентрацией углеводов 21.0 г / 100 см3 селекционным штаммом В - 3855, исходным Y-503 и промышленным - Я, показали перспективность использования отобранного штамма.
Предлагаемый штамм хранится на скошенном МПСГВ+агар в холодильнике при температуре 0±6°С.
Пример использования штамма.
Выращивание дрожжей с использованием предлагаемого штамма S. cerevisiae В - 3855 осуществляют в течение 72 ч глубинным методом в периодическом режиме в анаэробных условиях в лабораторной установке при температуре 30°С±1, рН 5.0 на мелассной питательной среде с геотермальной водой (МПСГВ) и содержанием углеводов 21.0 г / 100 см3 следующего состава (г/л):
- меласса 488.74
- гидроортофосфат аммония 2.58
- геотермальная вода с минерализацией 4.0-4.2 г/л с определенным качественным и количественным составом необходимым для выращивания дрожжей остальное
К мелассе добавляют разбавленную водопроводной водой геотермальную воду до содержания в среде углеводов 21.0 г/100 см3, гидроортофосфат аммония - 2.58 г/л, концентрированную серную кислоту, для достижения в среде рН 5.0, из расчета 0.4-0.6 мл на 100 г мелассы. Содержимое хорошо перемешивают. Стерильную питательную среду разливают по 1.5 л. в сосуды вместимостью 3 л., затем засевают вегетативной культурой указанного штамма в количестве 150 мл. из дрожжевой суспензии последней стадии адаптации на МПСГВ, 1 мл которой содержится 95.6 млн/мл клеток. В качестве пеногасителя используют структол 0.1 мл/1.5 л среды. По окончании 72-х часового эксперимента дрожжи отделяют от культуральной жидкости центрифугированием (5000g, 15 мин) на лабораторной стационарной центрифуге ЦЛС-344.2. По завершению эксперимента в сброженном субстрате определены остаточный сахар, накопление спирта и содержание примесных соединений. Наибольшее количество спирта отмечено в образце S. cerevisiae В - 3855 при минимальном содержании остаточного сахара (табл.1).
Усвоение раффинозы данной культурой (предлагаемый штамм) происходит в большей степени, чем исходным S. cerevisiae Y-503 и производственной расой Я (на 1/3), что обусловлено активацией фермента α-галактозидазы, катализирующего сбраживание этого углевода. Видимо, органические компоненты геотермальной воды (гуминовые кислоты), влияя на коллоиднохимические свойства протоплазмы и эффективность использования клеткой из питательной среды биологически активных веществ, усиливают тем самым ферментативную активность живой клетки.
Установлено, что опытный вариант имеет более высокий уровень активности β-фруктофуранозидазы, который проявляется с первых минут брожения. Обнаружено, что уровень активности альдолазы у штамма S. cerevisiae В - 3855 превышает показатели исходного и контрольного на 6 и 25% соответственно. Ключевым веществом анаэробного расщепления глюкозы и метаболизма Сахаров является пировиноградная кислота, разложение которой на ацетальдегид и СО2 катализируется пируватдекарбоксилазой. Полученные данные позволяют говорить о более высокой активности фермента в опытной живой биомассе на 27 и 37% по сравнению с исходной культурой и контролем. Заключительный этап брожения катализирует алкогольдегидрогеназа, восстанавливающая ацетальдегид до этанола. Активность данного фермента в клетках опытного варианта S. cerevisiae В - 3855 намного превышает данный показатель у исходного и контрольного (табл.2).
Анализ хроматограмм летучих примесей выявил идентичный качественный состав, причем штамм S. cerevisiae В - 3855 отличался количеством синтезируемых побочных метаболитов - 30.18% меньше по сравнению с S. cerevisiae Y-503, что является результатом изменения регуляторных функций клетки (табл.3). Так, S. cerevisiae В - 3855 синтезирует ацетальдегида почти вдвое меньше, чем штамм S. cerevisiae Y-503. Ацетон (на 29.16% меньше в опыте) может служить необходимым продуктом для образования высших спиртов, что нежелательно для получения основного продукта - этанола. С использованием культуры S. cerevisiae В - 3855 спирты: пропанол-1, изобутанол, бутанол-1, изоамилол и гексанол обнаружены в значительно меньшем количестве по сравнению со штаммом Y-503 (8518.24:10947.20 мг/дм3, опыт: исходный). В большей степени присутствие пропанола-1 и изоамилола в контроле на 30 и 14%, соответственно, ухудшает технологическую характеристику субстрата с приобретенным сивушным запахом. Увеличение концентрации кротональдегида, как сильного лакриматора, в контроле на 40% сообщает горечь, ухудшает пробу спирта на окисляемость. Содержание фенилалкоголя и бензальдегида - гликозида с запахом горького миндаля, превышает пороговые концентрации в субстратах, но с использованием культуры S. cerevisiae В - 3855 они меньше на 19.5% и 32.9% соответственно. Очевидно, положительные результаты исследований обусловлены биохимическими изменениями в клетке в результате проведенной адаптации и селекции к соответствующим условиям культивирования.
Таким образом, использование штамма дрожжей S.cerevisiae В - 3855, способного сбраживать мелассное сусло с концентрацией углеводов 21.0 г/100 см3, позволит интенсифицировать технологический процесс получения спирта до 12.4 об.%, снизить на 30% образование побочных метаболитов.
Библиография
1. Маринченко В.А., Метюгиев Б.Д., Щвец В.Н. Технология спирта из мелассы // Издательское объединение «Вища школа», Киев. 1975. С.75-153.
2. Микелов А.Н., Соболев Э.М., Боярский В.М. Бродильная способность рас дрожжей // Известия вузов. Пищ. технол. 1995. №5, 6. С.14-16.
3. Патент РФ №2329302 Способ сбраживания мелассного сусла / Ш.А.Абрамов, Э.А.Халилова // Б.И. 2008. №20.
4. А.с СССР №1284998 Штамм дрожжей Saccharomyces cerevisiae Y-503, используемый в производстве хлебобулочных изделий / Ш.А.Абрамов, С.Ц.Котенко, Б.И.Далгатова, А.Т.Маммаев // Б.И. 1986, №3.
5. Кудрявцев В.И. Систематика дрожжей. М.: Из-во АНСССР.1954, 212 с.

| Таблица №2 | ||||
| Культура | Ферменты(Е/мг) | |||
| β-фруктофура нозидаза | Альдолаза | Пируватдекар боксилаза | Алкогольдегид рогеназа | |
| S.cerevisiae Y-503 (исходный) | 29.3±1.96 | 0.33±0.03 | 15.2±1.19 | 0.55±0.05 |
| S.cerevisiae В - 3855 (опыт) | 33.4±1.59 | 0.38±0.02 | 18.1±1.30 | 0.74±0.06 |
| S.cerevisiae Я (контроль) | 27.4±1.78 | 0.26±0.02 | 12.3±1.15 | 0.45±0.03 |
| Таблица 3 | |||
| Продукт брожения | Единица измерения | Мелассная питательная среда с геотермальной водой | |
| Штамм Saccharomyces cerevisiae В - 3855 | Штамм Saccharomyces cerevisiae Y-503 | ||
| 1. Ацетальдегид | мг/дм3 | 2318.74 | 4637.48 |
| 2. Ацетон | = | 55.95 | 78.98 |
| 3. Этилацетат | = | 26.95 | 54.67 |
| 4. Пропанол-1 | = | 3700.84 | 5253.26 |
| 5. Изобутанол | = | 1116.52 | 1299.47 |
| 6. Бутанол-1 | = | 100.42 | 122.44 |
| 7. Изоамилол | = | 3593.68 | 4244.99 |
| 8. Гексанол | = | 6.78 | 27.04 |
| 9. Кротональдегид | = | 27.28 | 68.47 |
| 10. Фенилалкоголь | = | 580.33 | 720.88 |
| 11. Бензальдегид | = | 62.81 | 93.62 |
| Сумма примесных соединений | = | 11590.3 | 16601.3 |
Штамм дрожжей Saccharomyces cerevisiae ВКПМ В - 3855, используемый для получения спирта.
www.findpatent.ru
Штамм saccharomyces cerevisiae для получения биомассы хлебопекарных дрожжей
Изобретение относится к микробиологической, хлебопекарной и дрожжевой промышленности. Сконструирован штамм хлебопекарных дрожжей Y2477, не способный утилизировать фруктозу. Штамм депонирован во Всероссийской коллекции промышленных микроорганизмов под номером Y2477. Применение таких дрожжей в хлебопекарной промышленности позволит сократить содержание сахара в рецептурах сладких изделий и получать продукты с повышенным содержанием фруктозы. 2 табл.
Изобретение относится к микробиологической, хлебопекарной и дрожжевой промышленности.
В настоящее время для производства хлебопекарных дрожжей используются штаммы, способные к утилизации большинства моносахаров, в том числе и фруктозы. Использование таких дрожжей при выпечке изделий, в рецептурах которых содержится сахар (сахароза), сопряжено с расщеплением сахарозы до глюкозы и фруктозы, которые в ходе тестоведения усваиваются дрожжами. Поскольку основная сладость изделий связана с присутствием сахарозы или фруктозы, в ходе тестоприготовления она понижается. Таким образом, недостатком всех имеющихся на сегодняшний день хлебопекарных дрожжей является их способность к утилизации фруктозы, приводящая к повышенному расходу сахара. Целью данного изобретения является создание штамма хлебопекарных дрожжей, не усваивающих фруктозу. Применение таких дрожжей позволит производить сладкие хлебопекарные изделия с меньшим содержанием сахара за счет накопления в тесте фруктозы, которая является предпочтительным продуктом питания и имеет коэффициент сладости 1,7 по сравнению с сахарозой. Штамм Saccharomyces cerevisiae 8280-30А получен в результате мутагенеза гаплоидных сегрегантов дрожжей по признаку Fru- и последующего селекционно-гибридологического анализа выделенных мутантов. Штамм депонирован во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) под номером Y2477. Штамм характеризуется следующими культурально-морфологическими и физиолого-биохимическими признаками. Вегетативные клетки двухсуточной культуры, выращенной на твердой питательной среде с 2% глюкозы в качестве единственного источника углерода, имеют вытянутую, реже округлую форму, размер клеток 3,0 х 6,5 мкм, протоплазма гомогенная, размножение почкованием. При выращивании на твердой среде, содержащей дрожжевой экстракт и пептон (YEP) при 30oC через 72 ч роста колонии имеют следующий вид: 1) на среде YEP с глюкозой колонии белого цвета с ровным краем, блестящей поверхностью, конусообразным профилем, сметанообразной консистенцией; 2) на среде YEP с сахарозой колонии белого цвета с ровным краем, матовой поверхностью, линзовидным профилем и крупинчатой консистенцией; 3) на среде YEP с галактозой колонии белого цвета с матовой поверхностью, ровным краем, выпуклым профилем и крупинчатой консистенцией. Рост в жидкой среде На солодовом сусле при 35oC в течение первых 24 ч культивирования - жидкость мутная, осадок белый, не комкуется, пристеночной пленки не образует, запах этанола. На среде YEP, содержащей 3% крахмала в течение 20 ч культивирования - жидкость мутная, характерный запах дрожжей. Факультативный аэроб. Температура роста - 23-34-50oC (оптимум - 32oC). Значения pH при культивировании - 3,8-6,0 (оптимум - 4,5). Ассимиляция источников углерода: сбраживает глюкозу, галактозу, мальтозу, сахарозу, декстрины. Ассимиляция источников азота: усваивает аминокислоты, мочевину, сернокислый аммоний, азотнокислый аммоний. Отличительные особенности: при культивировании на твердой среде YEP с фруктозой наблюдается остаточный рост без образования отдельных колоний. Штамм Saccharomyces cerevisiae ВКПМ Y 2477 непатогенен. Штамм хранится на агаризованной богатой среде с глюкозой в течение 4 месяцев при +4oC. Примеры использования по назначению. Пример 1. Клетки штамма дрожжей Y2477 засевают в колбы с питательной средой YEP с глюкозой (2%), которые инкубируют на качалке при 30oC в течение 48 часов. Конечная плотность дрожжевой культуры - ОП 34. Дрожжевую биомассу отделяют центрифугированием и один раз промывают дистиллированной водой. У полученной таким образом биомассы дрожжей штамма Y2477 определяют хлебопекарные показатели по стандартным методикам (1), которые имеют следующие значения: зимазная активность - 52 мин; мальтазная активность - 49 мин; подъемная сила - 56 мин. Пример 2. Биомассу штамма дрожжей Y2477, полученную по примеру 1, используют для выпечки хлеба со следующей рецептурой: мука в/с - 375 г соль - 6 г сахар - 21 г масло - 23 г вода - 270 г дрожжи - 24 г После замеса тесто проходит этап расстойки в течение 1 ч 50 мин. Выпечка длится 1 ч. Показатели готовых изделий приведены в таблице 1. В образцах хлеба определено содержание Сахаров. Полученные результаты представлены в табл.2. Таким образом, как видно из представленных результатов, при использовании дрожжей штамма Y2477 в хлебе происходит накопление повышенного количества фруктозы. Источники информации 1. Инструкция по микробиологическому и технохимическому контролю дрожжевого производства. М.: Легкая и пищевая промышленность, 1984, с. 191.Формула изобретения
Штамм Saccharomyces cerevisiae ВКПМ Y 2477 для получения биомассы хлебопекарных дрожжей.РИСУНКИ
Рисунок 1Похожие патенты:

Изобретение относится к области медицины

Изобретение относится к пищевой и микробиологической промышленности, в частности к дрожжевому производству, и используется для охлаждения и термостатирования концентрата товарных дрожжей

Изобретение относится к пищевой биотехнологии и может быть использовано для получения хлебопекарных дрожжей, а точнее для получения активных сушеных дрожжей

Изобретение относится к области пищевой промышленности, а именно к хлебопекарной отрасли, и касается способа производства пшенично-ржаного хлеба "Измайловский"
Изобретение относится к пищевой промышленности, а именно, к производству бифидогенной добавки, используемой для ускорения роста заквасочных культур, содержащих бифидобактерии, а также восстановления нормальной микрофлоры кишечника человека при включении препарата в продукты питания в виде пищевой добавки
Изобретение относится к пищевой промышленности, в частности к бродильным производствам

Изобретение относится к промышленной микробиологии, в частности к производству дрожжей

Изобретение относится к области биотехнологии и может быть использовано при производстве хлебопекарных дрожжей
Изобретение относится к микробиологии, в частности к производству хлебопекарных дрожжей
Изобретение относится к биотехнологии

Изобретение относится к пищевой промышленности и, в частности, к спиртовой и пивоваренной отраслям
Изобретение относится к микробиологической, спиртовой и дрожжевой промышленности
Изобретение относится к микробиологической промышленности, в частности к производству хлебопекарных дрожжей, обогащенных физиологически активным веществом

Изобретение относится к производству хлебопекарных дрожжей
Изобретение относится к получению сушеных дрожжей
Изобретение относится к биотехнологии
Изобретение относится к биотехнологии

Изобретение относится к области биотехнологии и может быть использовано при производстве игристых вин

Изобретение относится к биохимическим способам активирования хлебопекарных прессованных дрожжей и может быть использовано в хлебопекарной и кондитерской отраслях пищевой промышленности
Изобретение относится к производству хлебопекарных дрожжей, обогащенных микроэлементами, и может широко использоваться при внедрении системы мер для профилактики йод-дефицитных состояний
Изобретение относится к микробиологической, хлебопекарной и дрожжевой промышленности
www.findpatent.ru
| Продажа велосипедов в Санкт-Петербурге.Велосипеды Stels на velikspb.ru Stels Navigator велосипеды Пивоваренные дрожжи, как и все дрожжи, — это одноклеточные организмы без хлорофилла, по морфологическим признакам их относят к классу Ascomycetes, семейству Saccharomycetaceae, роду Saccharomyces. Пиво является продуктом биохимической деятельности дрожжей. Наряду с составом сусла и технологическими условиями дрожжи играют ответственную роль в ходе процессов на всех стадиях производства пива и влияют на качество получаемого продукта. Важное значение для производства пива имеют физиологическое состояние дрожжей и условий их деятельности. Пивоваренные дрожжи, сбраживающие моносахара и мальтозу, делят на две группы: Верховые дрожжи сбраживают раффинозу на одну треть и образуют на поверхности сбраживающейся жидкости неосаждающуюся суспензию, имеющую вид плотной пены. Поэтому дрожжи этой группы получили название верховых, а пиво, для производства которого их применяют, называют пивом верхового брожения. Однако при использовании современных технологий при получении пива верхового брожения этот признак отсутствует: дрожжи в конце брожения оседают на дно аппарата. Процесс брожения верховыми дрожжами ведут при температуре 10—25 °С, при температуре ниже 10 °С он прекращается, после чего дрожжи оседают на дно. Низовые дрожжи сбраживают раффинозу полностью. После сбраживания дрожжи агрегатируются в виде хлопьев и оседают на дно бродильного аппарата. Поэтому их называют низовыми дрожжами, а получаемое пиво - пивом низового брожения. Сбраживание низовыми дрожжами протекает при температуре 6-8 °С и прекращается при О °С. Отличия физиологии поведения дрожжей обеих групп заключаются в следующем. Предполагают, что клетки верховых дрожжей и пузырьки углекислого газа несут противоположные электрические заряды, поэтому взаимно притягиваются. У низовых дрожжей с пузырьками углекислого газа предполагается одинаковый заряд, так что они взаимно отталкиваются. Основной отличительной особенностью разных групп дрожжей является их способность сбраживать раффинозу. Из ферментов, гидролизующих раффинозу, в ферментной системе низовых дрожжей находятся инвертаза и мелибиаза, а у верховых - только инвертаза. В связи с этим верховые дрожжи сбраживают раффинозу только на треть. Инвертаза гидролизует трисахарид раффинозы до моносахарида фруктозы и дисахарида мелибиозы, который далее может быть расщеплен только мелибиазой, содержащейся в низовых дрожжах, до глюкозы и галактозы. Кроме того, у низовых дрожжей в отличие от верховых нет фермента сукцинат-дегидрогеназы (янтарной дегидрогеназы), который функционально связан с цитохромом с и дыхательным ферментом Варбурга. Этим объясняется меньшая способность к размножению у низовых дрожжей, чем у верховых. Клетки пивоваренных дрожжей размерами 5...10х5...13 мкм имеют круглую или овальную форму, размножаются почкованием. Разница в форме отдельных клеток зависит от изменения состава среды, питания, наличия вредных примесей, в частности тяжелых металлов, изменения температуры и т. п. Значительные изменения формы дрожжевых клеток являются признаком дегенерации дрожжей. Здоровые дрожжи всегда наряду с крупными клетками имеют часть мелких, которые в период интенсивного роста не смогли еще достичь размеров взрослых клеток. При попадании дрожжей в неблагоприятные условия возникают сумки со ссорами, при этом вегетативные клетки превращаются в сумки со спорами. В одной сумке образуется 1-4, реже 8 спор. Споры шаровидные или овальные с гладкими оболочками. В благоприятных условиях споры снова превращаются в почкующиеся клетки: перед этим происходит разбухание и копуляция прорастающих спор или их почек. На сусло-агаре обычно формируются гладкие, тускло-блестящие, белые с желтоватым оттенком колонии. Для Saccharomyces cerevisiae характерен бродильный тип усвоения сахаров; при сбраживании сахаров образуется большое количество спирта, что определяет практическое значение дрожжей. Игры для девочек на http://games-for-you.ru/ | Saccharomyces cerevisiae -штаммы дрожжей верхового и низового брожения хотя и относятся согласно современной классификации к одному роду и виду Saccharomyces cerevisiae, имеют существенные различия по морфологическим, физиологическим и ряду производственно важных признаках. Далее... |
neobeer.narod.ru
 |  |  |  |  |  |  |  |  |  |  |  |  |  |  |
 Пример видео 3 Пример видео 3 |  Пример видео 2 Пример видео 2 |  Пример видео 6 Пример видео 6 |  Пример видео 1 Пример видео 1 |  Пример видео 5 Пример видео 5 |  Пример видео 4 Пример видео 4 |
Администрация муниципального образования «Городское поселение – г.Осташков»
























