Содержание
0362300003314000278 поставка тест-систем, питательных сред для микробиологических исследований
Требования к участникам
-
Единые требования к участникам (в соответствии с пунктом 1 части 1 Статьи 31 Федерального закона № 44-ФЗ)
-
Требование об отсутствии в предусмотренном Федеральным законом № 44-ФЗ реестре недобросовестных поставщиков (подрядчиков, исполнителей) информации об участнике закупки, в том числе информации об учредителях, о членах коллегиального исполнительного органа, лице, исполняющем функции единоличного исполнительного органа участника закупки — юридического лица (в соответствии с частью 1.1 Статьи 31 Федерального закона № 44-ФЗ)
Ограничения
- Условия и ограничения допуска товаров из иностранного государства
-
не установлены
Электронный аукцион признан несостоявшимся:
По результатам рассмотрения вторых частей заявок принято решение о несоответствии требованиям, установленным документацией об электронном аукционе, всех вторых частей заявок на участие в нем или о соответствии указанным требованиям только одной второй части заявки на участие в нем (ч. 8 ст.67 44-ФЗ)
8 ст.67 44-ФЗ)
Более подробная информация доступна, если войти или зарегистрироваться
| Участник | Цена, ₽ | Первые части заявок | Результаты отбора |
|---|---|---|---|
|
|
|
░░░░░ |
░░░░░ |
|
|
|
░░░░░ |
░░░░░ |
|
|
|
░░░░░ |
░░░░░ |
Производство
1.
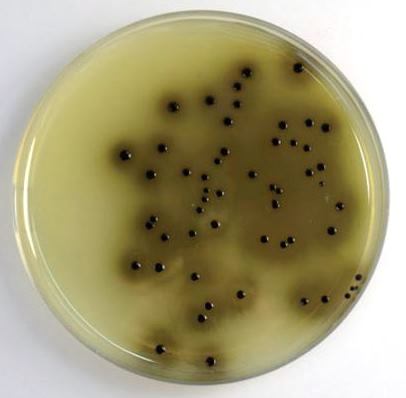 Среда питательная сухая для выделения и культивирования кампилобактерий
Среда питательная сухая для выделения и культивирования кампилобактерий
96 исследований
Область применения: медицина, лабораторная диагностика, выделение и дифференциация кампилобактерий.
Описание: чувствительность среды 10-6, показатель ингибиции ассоциативной микробной флоры (стафилококка и кишечной палочки) -10-1, скорость роста – 40-48 часов. Состав среды: пептон для бактериологических питательных сред, дрожжевой экстракт сухой, агар бактериологический, натрия хлорид, натрия карбонат. Селективная добавка: ванкомицин, полимиксин, триметоприм.
Состав комплекта: 5 пакетов основы препарата (105,6 г), рассчитанной на приготовление 2,5 л среды и 5 пенициллиновых флаконов селективной добавки к ней.
Особенности: сокращает время инкубации до 48 часов вместо 72 на среде прототипе, что позволяет ускорить предварительный диагноз; обеспечивает стабильные ростовые свойства возбудителя, поэтому с успехом может быть использована не только в клинической, но и санитарной микробиологии; доступность и низкая стоимость по сравнению с импортными средами позволяет более успешно решать задачи диагностики и лечения заболеваний, вызванных этим возбудителем.
Комплект рассчитан на 96 исследований.
Срок годности – 1 год
ТУ РБ 100558032.190-2010
Рег. уд. № ИМ-7.97001
Область применения. Медицина. Лабораторная диагностика кампилобактерий.
Описание товара. Код ТНВЭД. Чувствительность среды 10-6, показатель ингибиции ассоциативной микробной флоры (стафилококка и кишечной палочки) -10-1, скорость роста -40-48 часов. Состав среды: пептон для бактериологических питательных сред, дрожжевой экстракт сухой, агар бактериологический, натрия хлорид, натрия карбонат. Селективная добавка: ванкомицин, полимиксин, триметоприм.
Коробка: 260×200×65 мм, вес 105,6 г. Код ТНВЭД 3821000000
Преимущества по сравнению с зарубежными аналогами.
- сокращает время инкубации до 48 часов вместо 72 на среде прототипе, что позволяет ускорить предварительный диагноз;
- обеспечивает стабильные ростовые свойства возбудителя, поэтому с успехом может быть использована не только в клинической, но и санитарной микробиологии;
- доступность и низкая стоимость по сравнению с импортными средами позволяет более успешно решать задачи диагностики и лечения заболеваний, вызванных этим возбудителем.

Разработчик. Лаборатория клинической и экспериментальной микробиологии, заведующий лабораторией Титов Леонид Петрович, доктор медицинских наук,профессор; Газиумарова Людмила Дмитриевна, кандидат биологических наук, доцент.
т. +375-172376989
е-mail: [email protected]
2. Сухая питательная среда для определения чувствительности к антибиотикам
1250 исследований
Область применения: медицина, лабораторная диагностика, выделение и дифференциация патогенных и условно патогенных бактерий.
Описание: питательная среда предназначена для определения чувствительности микроорганизмов к антибиотикам диско-диффузионным методом. Соответствует требованиям ВОЗ. Расфасована в пластиковые банки по 250 г.
1 кг среды рассчитан на 1250 исследований
Срок годности – 1 год.
ТУ РБ 100558032.116-2007
Рег. уд. № ИМ-7.93456/0912
уд. № ИМ-7.93456/0912
Область применения. Медицина. Лабораторная диагностика патогенных и условно патогенных бактерий.
Код ТН ВЭД. – 3822000000
Описание товара. Питательная среда предназначена для определения чувствительности микроорганизмов к антибиотикам диско-диффузионным методом. Соответствует требованиям ВОЗ. Чувствительность – 99,9%, специфичность – 99,9%. Расфасовка в пластиковые банки, вес 250 г.
Состав на 1 литр среды: Мясной экстракт – 2.0г. Панкреатический гидролизат казеина – 17.5г Кукурузный крахмал – 1.5г Агар-агар – 17.0г. Навеска – 38г. рН 7.4+(-)0.2 при 25 0С.
Разработчик. Лаборатория клинической и экспериментальной микробиологии, заведующий лабораторией Титов Леонид Петрович, доктор мед. наук, профессор; Ермакова Татьяна Сергеевна, канд. биол. наук.
т. +375-172 37 69 89
e-mail: leonidtitov@tut.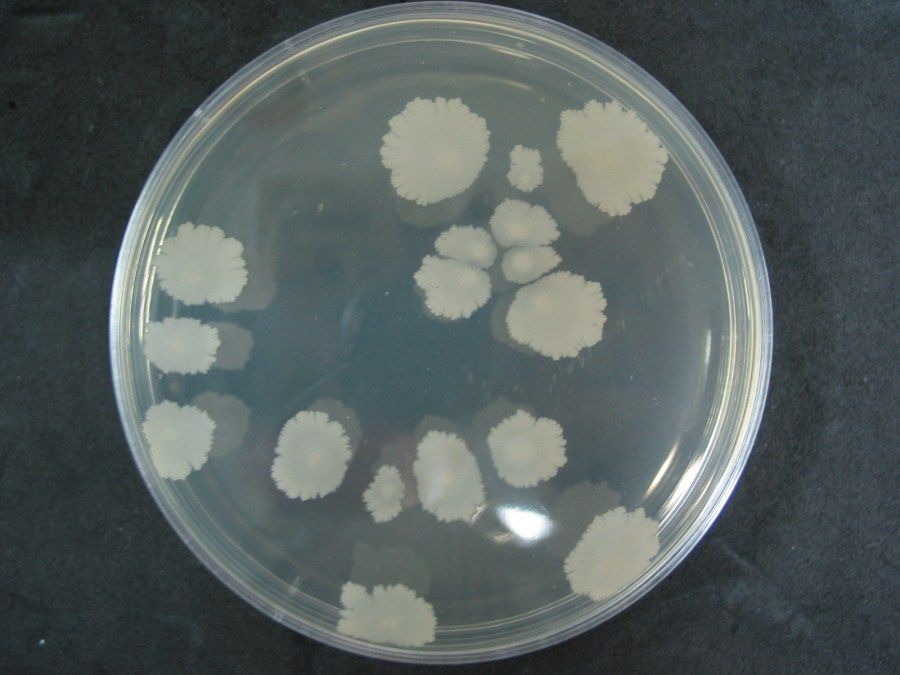 by
by
3.Среда питательная сухая для выделения и дифференциации E. coli O157:H7 (Сорбитол агар)
80 исследований
Область применения: медицина, лабораторная диагностика, выделение и дифференциация патогенных и непатогенных кишечных палочек из различных клинических источников, объектов окружающей среды, пищевых продуктов.
Описание: среда отличается высокой чувствительностью (наличие роста при посеве из разведения 10-6) и четкими дифференцирующими свойствами в отношении E.coli:H7 от других непатогенных бактерий этой группы; обладает элективными свойствами в отношении грамположительной кокковой флоры (стафилококки подавляются при разведении 10-1).
Состав среды: панкреатический гидролизат казеина, мясной экстракт, экстракт кормовых дрожжей, D-сорбитол, натрия хлорид, нейтральный красный, кристаллический фиолетовый, агар.
Комплект расфосован в 4 пакета из ламинированной бумаги, каждый из которых расчитан на приготовление 0,5 л среды (всего 80 исследований).
Срок годности – 1 год
ТУ РБ 100558032.151-2007
Рег. уд. № ИМ-7.93511
Область применения. Медицина. Лабораторная диагностика патогенных и непатогенных кишечных палочек из различных клинических источников, объектов окружающей среды, пищевых продуктов.
Описание товара. Код ТНВЭД. Среда отличается высокой чувствительностью (наличие роста при посеве из разведения 10-6) и четкими дифференцирующими свойствами в отношении E.coli:H7 от других непатогенных бактерий этой группы; обладает элективными свойствами в отношении грамположительной кокковой флоры (стафилококки подавляются при разведении 10-1). Состав среды: панкреатический гидролизат казеина, мясной экстракт, экстракт кормовых дрожжей, D-сорбитол, натрия хлорид, нейтральный красный, кристаллический фиолетовый, агар.
Коробка: 260×200×65 мм, вес 89 г. Код 3821000000
Рост культуры микроорганизмов на разработанной питательной среде: а- E. coli:H7, б — E.coli 055:К59
coli:H7, б — E.coli 055:К59
Преимущества по сравнению с зарубежными аналогами.
- отсутствие эффекта роения у бактерий рода сальмонелл (роящиеся виды), доступность и низкая стоимость по сравнению с импортными средами.
Разработчик. Лаборатория клинической и экспериментальной микробиологии, заведующий лабораторией Титов Леонид Петрович, доктор медицинских наук,профессор; Газиумарова Людмила Дмитриевна, кандидат биологических наук, доцент, Ермакова Татьяна Сергеевна, кандидат биологических наук, ведущий научный сотрудник.
т. +375-172376989
е-mail: [email protected]
4. Среда питательная сухая Конго Рот Агар
60 исследований
Область применения: медицина, лабораторная диагностика, выделение и дифференциация патогенных и условно-патогенных бактерий из различных источников, объектов окружающей среды, пищевых продуктов.
Описание: среда отличается высокой чувствительностью (наличие роста при посеве из разведения 10-6-10-7) и четкими дифференцирующими свойствами в отношении патогенных и условно-патогенных бактерий: E..jpg) coli –серо-голубые колонии с темным центром, St. aureus–оранжевые колонии с черным центром, Klebsiella pneumonia – выпуклые крупные колонии желтого цвета, S. typlii –колонии красного цвета.
coli –серо-голубые колонии с темным центром, St. aureus–оранжевые колонии с черным центром, Klebsiella pneumonia – выпуклые крупные колонии желтого цвета, S. typlii –колонии красного цвета.
Состав среды: панкреатический гидролизат казеина, лактоза, натрия сульфат, Конго красный, агар бактериологический.
Особенности: сокращает время инкубации (скорость роста) до 24 часов вместо 48 на среде прототипе, улучшены дифференцирующие свойства, подавлено роение протея, проста в приготовлении, более стандартна.
Набор содержит 3 пакета, каждый из которых расчитан на приготовление 500 мл среды (всего 60 исследований).
Срок годности – 1 год
ТУ РБ 100558032.143-2007
Рег. уд. № ИМ-7.93072
Описание товара. КодТНВЭД. Среда отличается высокой чувствительностью (наличие роста при посеве из разведения 10-6-10-7) и четкими дифференцирующими свойствами в отношении патогенных и условно-патогенных бактерий: E. coli–серо-голубые колонии с темным центром, St. aureus–оранжевые колонии с черным центром, Klebsiellapneumonia- выпуклые крупные колонии желтого цвета, S. typlii-колонии красного цвета. Состав среды: панкреатический гидролизат казеина, лактоза, натрия сульфат, Конго красный, агар бактериологический.
coli–серо-голубые колонии с темным центром, St. aureus–оранжевые колонии с черным центром, Klebsiellapneumonia- выпуклые крупные колонии желтого цвета, S. typlii-колонии красного цвета. Состав среды: панкреатический гидролизат казеина, лактоза, натрия сульфат, Конго красный, агар бактериологический.
Коробка: 206×132×65 мм, вес 172 г. КодТНВЭД 3821000000
Рост культур микроорганизмов на конго-рот агаре: 1-E.coli, 2- St. аureus.
Преимущества по сравнению с зарубежными аналогами.
- сокращает время инкубации (скорость роста) до 24 часов вместо 48 на среде прототипе, улучшены дифференцирующие свойства, подавлено роение протея, проста в приготовлении, более стандартна.
Разработчик. Лаборатория клинической и экспериментальной микробиологии, заведующий лабораторией Титов Леонид Петрович, доктор медицинских наук,профессор; Газиумарова Людмила Дмитриевна, кандидат биологических наук, доцент, Ермакова Татьяна Сергеевна, кандидат биологических наук, ведущий научный сотрудник.
т. +375-172376989
е-mail: [email protected]
5. Среда для культивирования Haemophilus spp.
100 исследований
Область применения: клиническая бактериология
Описание: подавляет рост сопутствующей гемофилам грамположительной и грамотрицательной бактериальной микрофлоры, дифференцирует по внешнему виду колоний патогенные Haemophilus influenzae от непатогенных Haemophilus parainfluenzae Набор позволяет приготовить среду на 100 чашек Петри.
6. Среда питательная сухая для иерсиний
100 исследований
Область применения: клиническая бактериология
Описание: предназначена для выделения возбудителей кишечного иерсиниоза и псевдотуберкулёза и дифференциации их от других энтеробактерий.
7. Среда для культивирования Clostridium difficile
500 мл среды (25 чашек Петри)
Область применения: клиническая микробиология, бактериология.
Описание: среда предназначена для выделения и предварительной идентификации Clostridium difficile от пациентов и с объектов внешней среды. Среда подавляет рост сопутствующей микрофлоры и дифференцирует C.difficile по ферментативной активности в отношении фруктозы.
8. Среда питательная Левенштейна-Йенсена для туберкулезных микобактерий (картофельно-солевая смесь)
400 мл (80 исследований)
Область применения: медицинская и ветеринарная микробиология, микробиологическая диагностика туберкулеза.
Описание: предназначена для культивирования всех видов микобактерий.
9. Среда питательная Финна-II для туберкулезных микобактерий (жидкая солевая основа)
400 мл (80 исследований)
Область применения: медицинская и ветеринарная диагностика, микробиологическая диагностика туберкулеза.
Описание: среда представляет собой стерильную жидкость бирюзово-зеленого цвета и предназначена для приготовления твердой среды Финна-II. Среда используется для выделения и культивирования широкого спектра видов и групп микобактерий человека и животных.
Среда используется для выделения и культивирования широкого спектра видов и групп микобактерий человека и животных.
10. Среда питательная сухая для культивирования и выделения листерий
150 исследований
Область применения: медицина, лабораторная диагностика листериоза.
Описание: среда предназначена для культивирования и выделения листерий из различных клинических источников, пищевых продуктов и объектов внешней среды. Среда отличается высокой чувствительностью по отношению к выделяемой культуре и хорошим ингибирующим эффектом к бактериям-ассоциантам. основным преимущественным отличием от известных питательных сред является полноценный рецептурный состав, простота изготовления из сухих ингредиентов и экономическая целесообразность.
11. Среда обогащения для листерий
96 исследований
Область применения: медицина, лабораторная диагностика листериоза.
Описание: среда предназначена для наращивания биомассы листерий с целью обнаружения единичных клеток возбудителя в клиническом материале (кровь, испражнения, отделяемое репродуктивных органов), объектах окружающей среды и продуктах питания
Особенности: среда отличается высокой чувствительностью по отношению к выделяемой культуре (наличие роста при посеве около 10 м. т. и хорошим ингибирующим эффектом к бактериям-ассоциантам (Proteus vulgaris, E.coli 25922). Показатель ингибиции последних не менее 10 000 м.к. через 48 ч инкубации при температуре (36±1)0С.
т. и хорошим ингибирующим эффектом к бактериям-ассоциантам (Proteus vulgaris, E.coli 25922). Показатель ингибиции последних не менее 10 000 м.к. через 48 ч инкубации при температуре (36±1)0С.
Простой и быстрый протокол получения дрожжевого экстракта из Saccharomyces cerevisiae, подходящего для приготовления бактериальных культуральных сред
Iran J Pharm Res. 2016 Осень; 15(4): 907–913.
, a, b, c , a, d and a, d, *
Author information Article notes Copyright and License information Disclaimer
Yeasts, especially Saccharomyces cerevisiae, — один из старейших организмов с широким спектром применения благодаря своей уникальной генетике и физиологии. Экстракт дрожжей, то есть продукт дрожжевых клеток, широко используется в качестве питательного ресурса в бактериальных культуральных средах.
Целью данного исследования была разработка простого, быстрого и рентабельного процесса производства дрожжевого экстракта. В этой процедуре для получения дрожжевого экстракта использовались механические методы, такие как высокая температура и давление. Рост бактерий, подаваемых с полученным дрожжевым экстрактом, отслеживали для оценки качества продукта. Результаты показали, что качество полученного дрожжевого экстракта было очень многообещающим, о чем свидетельствует картина роста бактериальных клеток в среде, приготовленной из этого продукта, и было сравнимо с качеством трех коммерческих дрожжевых экстрактов с точки зрения свойств роста бактерий. Одним из основных преимуществ текущего метода было то, что не использовались химикаты и ферменты, что привело к снижению производственных затрат. Этот метод очень прост и эффективен с точки зрения затрат, и может быть выполнен в разумные сроки, что делает его пригодным для использования в исследовательских лабораториях. Кроме того, его можно масштабировать для производства больших количеств для промышленного применения.
В этой процедуре для получения дрожжевого экстракта использовались механические методы, такие как высокая температура и давление. Рост бактерий, подаваемых с полученным дрожжевым экстрактом, отслеживали для оценки качества продукта. Результаты показали, что качество полученного дрожжевого экстракта было очень многообещающим, о чем свидетельствует картина роста бактериальных клеток в среде, приготовленной из этого продукта, и было сравнимо с качеством трех коммерческих дрожжевых экстрактов с точки зрения свойств роста бактерий. Одним из основных преимуществ текущего метода было то, что не использовались химикаты и ферменты, что привело к снижению производственных затрат. Этот метод очень прост и эффективен с точки зрения затрат, и может быть выполнен в разумные сроки, что делает его пригодным для использования в исследовательских лабораториях. Кроме того, его можно масштабировать для производства больших количеств для промышленного применения.
Ключевые слова: Пекарские дрожжи, дрожжевой экстракт, рост бактерий, Saccharomyces cerevisiae
Дрожжи являются важными эукариотическими микроорганизмами, принадлежащими к царству грибов. С исторической точки зрения, тысячи лет назад они использовались для самых разных целей, таких как ферментация, выпечка и биоремедиация (1-3), а также для широкого спектра исследований в биологических науках благодаря их уникальной генетике и физиологии. (4-8). Кроме того, питательные вещества клеток дрожжей, известные как «дрожжевой экстракт», также используются для многих важных целей. Экстракт дрожжей представляет собой переработанный дрожжевой продукт, содержащий растворимые компоненты клеток дрожжей и широко используемый в пищевой промышленности в качестве пищевых ароматизаторов, добавок и витаминных добавок, а также в качестве питательного ресурса для бактериальных питательных сред, используемых в микробиологии и биотехнологии (9).-10). Более того, важность использования дрожжевого экстракта в промышленной ферментации для производства микробной биомассы или продуктов была доказана многочисленными исследованиями (11-14). Различные виды дрожжей, особенно Saccharomyces cerevisiae (известные как пекарские дрожжи), использовались для производства дрожжевого экстракта (15-17).
С исторической точки зрения, тысячи лет назад они использовались для самых разных целей, таких как ферментация, выпечка и биоремедиация (1-3), а также для широкого спектра исследований в биологических науках благодаря их уникальной генетике и физиологии. (4-8). Кроме того, питательные вещества клеток дрожжей, известные как «дрожжевой экстракт», также используются для многих важных целей. Экстракт дрожжей представляет собой переработанный дрожжевой продукт, содержащий растворимые компоненты клеток дрожжей и широко используемый в пищевой промышленности в качестве пищевых ароматизаторов, добавок и витаминных добавок, а также в качестве питательного ресурса для бактериальных питательных сред, используемых в микробиологии и биотехнологии (9).-10). Более того, важность использования дрожжевого экстракта в промышленной ферментации для производства микробной биомассы или продуктов была доказана многочисленными исследованиями (11-14). Различные виды дрожжей, особенно Saccharomyces cerevisiae (известные как пекарские дрожжи), использовались для производства дрожжевого экстракта (15-17). Экстракт дрожжей производится с использованием различных методов, таких как методы, основанные на методах автолиза и гидролиза. Целью различных методов является разрушение клеточной стенки дрожжей (для высвобождения клеточного содержимого) и восстановление растворимой фракции. В зависимости от цели производства процедура получения дрожжевого экстракта различается. Например, если цель производства дрожжевого экстракта состоит в том, чтобы использовать его в пищевой или косметической промышленности, требуется несколько этапов для получения пищевого/косметического дрожжевого экстракта. Эти этапы включают множество физических, химических и ферментативных методов разрушения клеточной стенки дрожжей, за которыми следуют несколько дополнительных этапов, таких как фильтрация, хроматография или другие методы разделения для удаления нерастворимых материалов с целью получения продукта без запаха, вкуса и цвета (18-19).). Хотя качество дрожжевого экстракта улучшается за счет применения этих дополнительных процедур, большинство из этих стадий очень трудоемки, отнимают много времени, дороги и несущественны, когда целью производства является использование дрожжевого экстракта для микробиологических исследований в качестве одного из основных компонентов.
Экстракт дрожжей производится с использованием различных методов, таких как методы, основанные на методах автолиза и гидролиза. Целью различных методов является разрушение клеточной стенки дрожжей (для высвобождения клеточного содержимого) и восстановление растворимой фракции. В зависимости от цели производства процедура получения дрожжевого экстракта различается. Например, если цель производства дрожжевого экстракта состоит в том, чтобы использовать его в пищевой или косметической промышленности, требуется несколько этапов для получения пищевого/косметического дрожжевого экстракта. Эти этапы включают множество физических, химических и ферментативных методов разрушения клеточной стенки дрожжей, за которыми следуют несколько дополнительных этапов, таких как фильтрация, хроматография или другие методы разделения для удаления нерастворимых материалов с целью получения продукта без запаха, вкуса и цвета (18-19).). Хотя качество дрожжевого экстракта улучшается за счет применения этих дополнительных процедур, большинство из этих стадий очень трудоемки, отнимают много времени, дороги и несущественны, когда целью производства является использование дрожжевого экстракта для микробиологических исследований в качестве одного из основных компонентов. сред для культивирования бактериальных клеток.
сред для культивирования бактериальных клеток.
Несмотря на наличие многочисленных коммерческих дрожжевых экстрактов для приготовления микробных культуральных сред, простой метод приготовления высококачественного дрожжевого экстракта будет иметь большое значение. Принимая во внимание важность и широкий спектр применения дрожжевого экстракта в средах микробного брожения, наша цель в текущем исследовании состояла в том, чтобы разработать простой, быстрый и рентабельный процесс производства дрожжевого экстракта, применимого в различных лабораториях, чтобы удовлетворить экспериментальных потребностей, а также для использования в промышленности в качестве основного компонента среды микробного брожения в больших количествах.
Приготовление дрожжевого экстракта
Водную суспензию клеток дрожжей готовили путем добавления 500 г пекарских дрожжей ( Saccharomyces cerevisiae ) к 2 л деионизированной воды (вода Milli-Q). Приготовленную суспензию автоклавировали при 115 °С в течение 10 мин с последующим быстрым охлаждением на льду.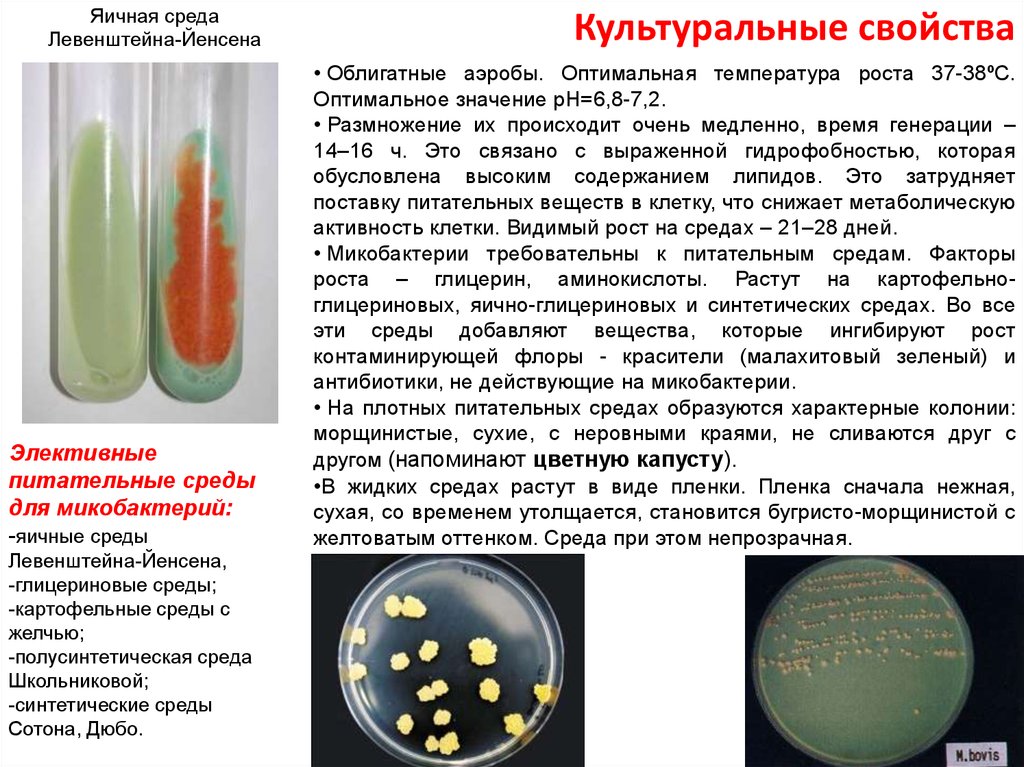 Затем клеточный дебрис отделяли центрифугированием при 400 g при 4°С в течение 10 мин. Супернатант повторно центрифугировали снова при тех же условиях, чтобы убедиться в удалении нерастворимого клеточного содержимого. Полученный супернатант, содержащий растворимый компонент, повторно автоклавировали и снова охлаждали, как описано выше. Полученный водорастворимый экстракт хранили при –20 °С до получения дрожжевого экстракта в виде порошка. Затем растворимую фракцию подвергали мини-распылительной сушилке (B-29).0, Büchi Labortechnik AG, Flawil, Швейцария) для получения порошкообразной формы дрожжевого экстракта.
Затем клеточный дебрис отделяли центрифугированием при 400 g при 4°С в течение 10 мин. Супернатант повторно центрифугировали снова при тех же условиях, чтобы убедиться в удалении нерастворимого клеточного содержимого. Полученный супернатант, содержащий растворимый компонент, повторно автоклавировали и снова охлаждали, как описано выше. Полученный водорастворимый экстракт хранили при –20 °С до получения дрожжевого экстракта в виде порошка. Затем растворимую фракцию подвергали мини-распылительной сушилке (B-29).0, Büchi Labortechnik AG, Flawil, Швейцария) для получения порошкообразной формы дрожжевого экстракта.
Оценка роста бактериальных клеток
Для оценки качества продукта контролировали рост бактерий, питаемых полученным дрожжевым экстрактом. С этой целью готовили различные питательные среды для бактерий в твердом или жидком виде. В первом подходе мы использовали только дрожжевой экстракт в качестве единственного источника питательных веществ в средах для культивирования бактериальных клеток. Для этой цели твердые и жидкие среды готовили по следующему протоколу: для твердой среды смесь 8 г полученного порошка дрожжевого экстракта и 15 г агара (Merck, Дармштадт, Германия) растворяли в 1 л деионизированной воды и автоклавировали (121°С). C, 15 фунтов) в течение 15 мин с последующим распределением в стерильные пластиковые чашки диаметром 8 см. В качестве среды отрицательного контроля также готовили аналогичную твердую среду без порошка дрожжевого экстракта. Для жидкой среды 20 г полученного порошка дрожжевого экстракта растворяли в конечном объеме 1 л деионизированной воды и автоклавировали, как указано выше. Охлажденную среду разливают по стерильным пробиркам. Также была приготовлена аналогичная среда отрицательного контроля (т.е. среда без дрожжевого экстракта). Бактерии, использованные для культивирования на приготовленных средах, были E. coli (DH5α) и Staphylococcus aureus (PTCC 1112) как грамотрицательные и грамположительные бактерии соответственно.
Для этой цели твердые и жидкие среды готовили по следующему протоколу: для твердой среды смесь 8 г полученного порошка дрожжевого экстракта и 15 г агара (Merck, Дармштадт, Германия) растворяли в 1 л деионизированной воды и автоклавировали (121°С). C, 15 фунтов) в течение 15 мин с последующим распределением в стерильные пластиковые чашки диаметром 8 см. В качестве среды отрицательного контроля также готовили аналогичную твердую среду без порошка дрожжевого экстракта. Для жидкой среды 20 г полученного порошка дрожжевого экстракта растворяли в конечном объеме 1 л деионизированной воды и автоклавировали, как указано выше. Охлажденную среду разливают по стерильным пробиркам. Также была приготовлена аналогичная среда отрицательного контроля (т.е. среда без дрожжевого экстракта). Бактерии, использованные для культивирования на приготовленных средах, были E. coli (DH5α) и Staphylococcus aureus (PTCC 1112) как грамотрицательные и грамположительные бактерии соответственно.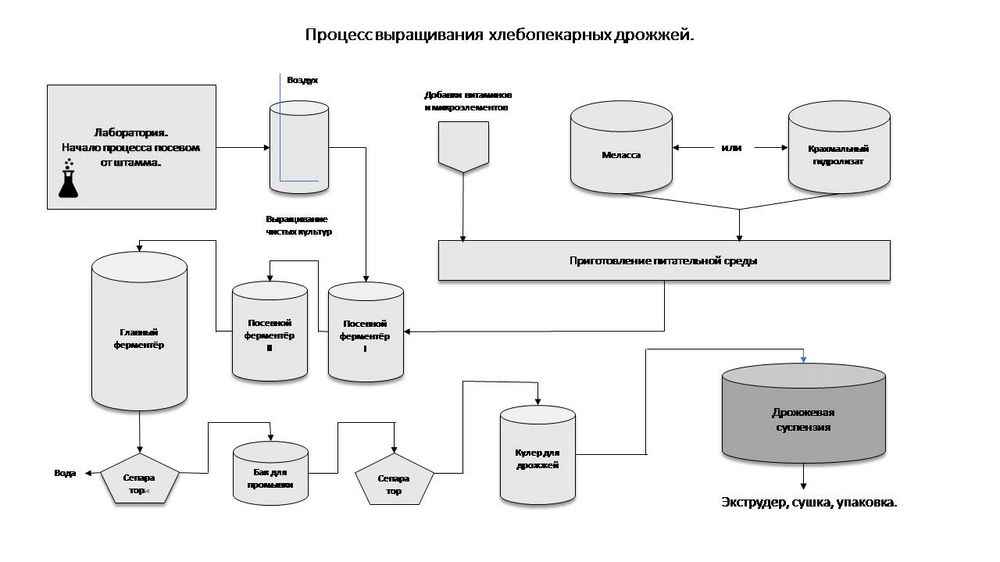 Для твердых сред бактерии высевали штрихом на чашку и инкубировали в течение ночи при 37°С. В случае жидких сред свежую ночную культуру бактерий разбавляли 1:100 в среде и инкубировали при 37°С при встряхивании со скоростью 180 об/мин. Через разные промежутки времени (т.е. 2, 4, 8, 16, 24 и 48 ч) в стерильных условиях отбирали образцы для мониторинга роста бактерий в приготовленных средах путем считывания оптической плотности (ОП) образцов при 600 нм с использованием УФ-излучения. спектрофотометр (Ultrospec 2000, Amersham Pharmacia Biotech). Каждый эксперимент проводили в трехкратной повторности.
Для твердых сред бактерии высевали штрихом на чашку и инкубировали в течение ночи при 37°С. В случае жидких сред свежую ночную культуру бактерий разбавляли 1:100 в среде и инкубировали при 37°С при встряхивании со скоростью 180 об/мин. Через разные промежутки времени (т.е. 2, 4, 8, 16, 24 и 48 ч) в стерильных условиях отбирали образцы для мониторинга роста бактерий в приготовленных средах путем считывания оптической плотности (ОП) образцов при 600 нм с использованием УФ-излучения. спектрофотометр (Ultrospec 2000, Amersham Pharmacia Biotech). Каждый эксперимент проводили в трехкратной повторности.
В качестве дополнительной оценки бактериальный рост отслеживали в бульонной среде Лурия Бертани (обычно используемой в микробиологии среде), приготовленной с использованием дрожжевого экстракта, полученного в этом исследовании, и экстрактов, полученных от коммерческих поставщиков. Бульонную среду LB готовили следующим образом: 5 г порошка дрожжевого экстракта, 10 г триптона (HiMedia, кат. №: RM014) и 5 г NaCl (Scharlau, кат. №: SO0225) растворяли в 1 л деионизированной воды с последующим автоклавирование и розлив в стерильные пробирки. Чтобы сравнить профиль роста бактериальных клеток в среде, приготовленной из дрожжевого экстракта нашего производства, с аналогичными коммерческими продуктами дрожжевого экстракта, три разных дрожжевых экстракта известных компаний, а именно, Sigma (кат. №: 92144-F), Merck (кат. №: 1.03753) и Applichem (кат. №: A3732). Среду, содержащую все ингредиенты, кроме дрожжевого экстракта, готовили и использовали в качестве отрицательной контрольной среды. Все процедуры, связанные с бактериальным культивированием и мониторингом роста бактериальных клеток, проводили, как описано выше.
№: RM014) и 5 г NaCl (Scharlau, кат. №: SO0225) растворяли в 1 л деионизированной воды с последующим автоклавирование и розлив в стерильные пробирки. Чтобы сравнить профиль роста бактериальных клеток в среде, приготовленной из дрожжевого экстракта нашего производства, с аналогичными коммерческими продуктами дрожжевого экстракта, три разных дрожжевых экстракта известных компаний, а именно, Sigma (кат. №: 92144-F), Merck (кат. №: 1.03753) и Applichem (кат. №: A3732). Среду, содержащую все ингредиенты, кроме дрожжевого экстракта, готовили и использовали в качестве отрицательной контрольной среды. Все процедуры, связанные с бактериальным культивированием и мониторингом роста бактериальных клеток, проводили, как описано выше.
Анализ состава продукта
Количественный анализ состава полученного дрожжевого экстракта был проведен в эталонной лаборатории (лаборатория ASA, Тегеран, Иран). Общее количество белка, жира, золы, хлорида натрия, общего летучего азота (TVN), влаги и pH были анализируемыми химическими свойствами.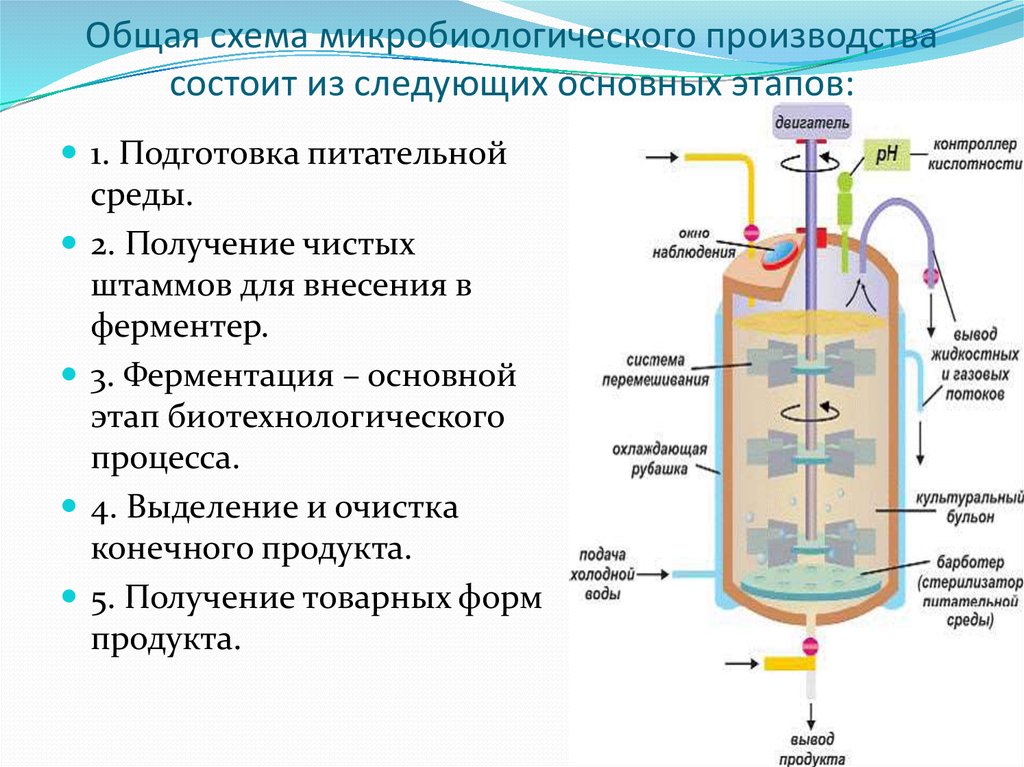
Статистический анализ
Все статистические анализы для сравнения роста бактерий в бульонных средах LB, приготовленных с использованием различных дрожжевых экстрактов, проводились с использованием t-критерия, реализованного в программе SPSS (версия 21.0). Значение p <0,05 считалось статистически значимым.
Производство дрожжевого экстракта
В настоящей работе для приготовления дрожжевого экстракта использовали пекарские дрожжи ( Saccharomyces cerevisiae ) . Водную суспензию дрожжей готовили с последующим автоклавированием и центрифугированием для получения растворимой фракции. Эти этапы (центрифугирование и автоклавирование) повторяли еще раз для полного удаления клеточного дебриса. Супернатант наносили на распылительную сушилку для получения порошкообразного дрожжевого экстракта.
Оценка роста бактериальных клеток в твердых и жидких средах
E. coli DH5α и Staphylococcus aureus , как представителей грамотрицательных и грамположительных типов бактерий, соответственно, использовали для систематического определения роста бактерий как в твердой, так и в жидкой среде, приготовленной из полученного дрожжевого экстракта. Результат показал, что обе бактерии могут расти в твердой среде, содержащей полученный дрожжевой экстракт в качестве единственного источника питательной поддержки. . показаны колонии E. coli DH5α и Staphylococcus aureus, соответственно. На контрольных средах для обеих бактерий (.) колоний не наблюдалось. . продемонстрировать скорость роста E. coli DH5α и Staphylococcus aureus в жидкой бульонной среде, состоящей из полученного дрожжевого экстракта в качестве единственного источника энергии, соответственно. Графики показывают, что качество дрожжевого экстракта, полученного в этой работе, достаточно высокое, чтобы его можно было использовать в качестве единственного источника питания для роста бактериальных клеток.
Результат показал, что обе бактерии могут расти в твердой среде, содержащей полученный дрожжевой экстракт в качестве единственного источника питательной поддержки. . показаны колонии E. coli DH5α и Staphylococcus aureus, соответственно. На контрольных средах для обеих бактерий (.) колоний не наблюдалось. . продемонстрировать скорость роста E. coli DH5α и Staphylococcus aureus в жидкой бульонной среде, состоящей из полученного дрожжевого экстракта в качестве единственного источника энергии, соответственно. Графики показывают, что качество дрожжевого экстракта, полученного в этой работе, достаточно высокое, чтобы его можно было использовать в качестве единственного источника питания для роста бактериальных клеток.
Открыть в отдельном окне
Выращивание бактерий на твердых средах, приготовленных из полученного дрожжевого экстракта, как единственного источника энергии для бактерий. (A) Колонии из Стафилококк
au r eus в виде грамположительных бактерий на твердых средах, приготовленных из полученного дрожжевого экстракта. (B) Колонии E.
(B) Колонии E.
coli DH5α в виде грамотрицательных бактерий на плотных средах, приготовленных из полученного дрожжевого экстракта. (C и D) Твердая среда без дрожжевого экстракта в качестве контроля для культивирования Staphylococcus
au r eu и E.
coli DH5α соответственно. Как видно на контрольных чашках, в среде отсутствуют колонии. Опыты проводились в трехкратной повторности.
Открыть в отдельном окне
(A) Модель роста E.
coli DH5α как грамотрицательные бактерии (B) и Staphylococcus
au r eus в виде грамположительных бактерий на жидких средах, приготовленных из полученного дрожжевого экстракта (в качестве единственного источника энергии) в различные промежутки времени. Как видно, количество бактерий увеличивается в течение 48 часов для обоих видов бактерий. Показаны средние значения оптической плотности для трех отдельных экспериментов в разное время и соответствующее стандартное отклонение 9. 0003
0003
Качество полученного дрожжевого экстракта также оценивали как один из компонентов бульонной среды LB и сравнивали с тремя коммерческими дрожжевыми экстрактами. Результаты показали, что оба типа бактерий были способны расти в среде LB, приготовленной из полученного дрожжевого экстракта, сравнимой с таковой в среде LB, приготовленной с использованием трех коммерческих дрожжевых экстрактов (. и .). Статистический анализ показал, что нет существенных различий между скоростями роста обоих типов бактерий в бульонной среде LB, приготовленной как с нашим продуктом дрожжевого экстракта, так и с тремя коммерческими. Сравнение скорости роста бактерий в среде LB, приготовленной с использованием полученного дрожжевого экстракта, со скоростью роста в контрольной среде, лишенной какого-либо дрожжевого экстракта, выявило значительную разницу для обоих типов бактерий. Разница наблюдалась через 4–48 ч после инокуляции E. coli и 8–48 ч для Staphylococcus aureus (значение p <0,05) (. и .).
и .).
Открыть в отдельном окне
A) Профиль роста бактериальных клеток для E.
coli DH5α в виде грамотрицательных бактерий на бульонной среде Лурия Бертани, приготовленной из дрожжевого экстракта, полученного в этом исследовании, и коммерческих продуктов (Applichem, Merck и Sigma). В качестве контроля использовали среду без экстракта дрожжей. Для каждой точки данных были проведены тройные определения. Для ясности стандартные отклонения показаны только для среды, приготовленной из нашего дрожжевого экстракта, а также для контрольной среды. (B) Гистограмма Э.
Рост coli DH5α в другой среде LB. Результаты показывают, что нет существенной разницы между скоростью роста бактерий в бульонной среде LB, дополненной полученным дрожжевым экстрактом, и в бульонной среде LB, содержащей три коммерческих экстракта дрожжей (значение p>0,05). Анализ показывает существенную разницу между скоростью роста E.
coli DH5α на среде LB, приготовленной из дрожжевого экстракта нашего производства, и контроль через 4, 8, 16, 24 и 48 ч инокуляции (значение p <0,05). Значимые различия отмечены звездочками (*).
Значимые различия отмечены звездочками (*).
Открыть в отдельном окне
(A) Профиль роста бактериальных клеток для Staphylococcus
au r eus в виде грамположительных бактерий на бульонной среде Luria Bertani, приготовленной из дрожжевого экстракта, полученного в этом исследовании, и коммерческих продуктов (Applichem, Merck и Sigma). В качестве контроля использовали среду без экстракта дрожжей. Для каждой точки данных были проведены тройные определения. Для ясности стандартные отклонения показаны только для среды, приготовленной из нашего дрожжевого экстракта, а также для контрольной среды. (B) Гистограмма Стафилококк
au r eus рост в другой среде LB. Результаты показывают, что нет существенной разницы между скоростью роста бактерий в бульонной среде LB, дополненной полученным дрожжевым экстрактом, и в бульонной среде LB, содержащей три коммерческих экстракта дрожжей (значение p>0,05). Анализ показывает значительную разницу между скоростью роста стафилококка и
au r eus на среде LB, приготовленной из дрожжевого экстракта нашего производства, и контроля через 8, 16, 24 и 48 ч после инокуляции (значение p <0,05). Значимые различия отмечены звездочками (*).
Значимые различия отмечены звездочками (*).
Анализ состава дрожжевого экстракта
Количественные анализы полученного порошка дрожжевого экстракта показали, что экстракт содержит: белок (30%), жир (0,42%), хлорид натрия (0,67%), зола (12,18%), общий летучий азот (9,2%) с влагой 4,72% и рН 6,29.
Дрожжевой экстракт представляет собой продукт клеток дрожжей, содержащий аминокислоты, липиды, витамины, минеральные вещества и другие растворимые компоненты, находящий широкое применение в пищевой промышленности, а также в качестве источника питания для микробных культур в области исследований молекулярной биологии и ферментационной промышленности (20-22 ). Двумя распространенными подходами к производству дрожжевого экстракта являются автолиз и гидролиз, однако это не исчерпывающая классификация, и многие методы не подпадают под эту классификацию. Автолиз, естественное явление, происходящее после гибели клетки, представляет собой саморасщепление клеточных составляющих дрожжевой клетки под действием высвобождаемых эндогенных пищеварительных ферментов. Сообщалось о нескольких стратегиях улучшения процесса автолиза, таких как изменение температуры, pH и осмотического давления, облучение рентгеновскими лучами и механическое измельчение или использование хитозана, химических индукторов, таких как органические растворители и поваренная соль (23-26). Процесс автолиза связан с некоторыми недостатками, такими как низкий выход экстракции, сложность разделения твердой и жидкой фаз из-за риска микробного загрязнения в результате длительной инкубации. В методе гидролиза для разрушения содержимого клетки используются различные экзогенные ферменты, кислоты или щелочи (27-29). Применение экзогенных ферментов в процессе гидролиза удорожает производство, кроме того, использование кислот или щелочей в этом процессе усложнит процессы очистки.
Сообщалось о нескольких стратегиях улучшения процесса автолиза, таких как изменение температуры, pH и осмотического давления, облучение рентгеновскими лучами и механическое измельчение или использование хитозана, химических индукторов, таких как органические растворители и поваренная соль (23-26). Процесс автолиза связан с некоторыми недостатками, такими как низкий выход экстракции, сложность разделения твердой и жидкой фаз из-за риска микробного загрязнения в результате длительной инкубации. В методе гидролиза для разрушения содержимого клетки используются различные экзогенные ферменты, кислоты или щелочи (27-29). Применение экзогенных ферментов в процессе гидролиза удорожает производство, кроме того, использование кислот или щелочей в этом процессе усложнит процессы очистки.
Исследования показывают, что в некоторых протоколах использовались различные механические процедуры для улучшения процессов авто- или гидролиза, но они не использовались отдельно для производства дрожжевого экстракта (30-31). В настоящей работе мы разработали быстрый механический способ получения дрожжевого экстракта из пекарских дрожжей (9).0025 Saccharomyces cerevisiae ) для использования в качестве питательного агента в питательной среде для бактерий. В этом методе к суспензии дрожжевых клеток применяли высокую температуру и давление с последующим быстрым охлаждением. Он вызывает потерю целостности клеточной мембраны, вызывая шок у дрожжевых клеток, что нельзя рассматривать как метод, основанный ни на автолизе, ни на гидролизе. В дальнейшем растворимую фракцию экстракта подвергали распылительной сушке для получения дрожжевого экстракта в виде порошка, более пригодного для хранения. Качество полученного дрожжевого экстракта было очень многообещающим, о чем можно было судить по характеру роста бактериальных клеток в среде, приготовленной из этого продукта. Важно отметить, что полученный дрожжевой экстракт мог использоваться бактериями в качестве единственного источника энергии в бактериальных твердых и жидких средах (.
В настоящей работе мы разработали быстрый механический способ получения дрожжевого экстракта из пекарских дрожжей (9).0025 Saccharomyces cerevisiae ) для использования в качестве питательного агента в питательной среде для бактерий. В этом методе к суспензии дрожжевых клеток применяли высокую температуру и давление с последующим быстрым охлаждением. Он вызывает потерю целостности клеточной мембраны, вызывая шок у дрожжевых клеток, что нельзя рассматривать как метод, основанный ни на автолизе, ни на гидролизе. В дальнейшем растворимую фракцию экстракта подвергали распылительной сушке для получения дрожжевого экстракта в виде порошка, более пригодного для хранения. Качество полученного дрожжевого экстракта было очень многообещающим, о чем можно было судить по характеру роста бактериальных клеток в среде, приготовленной из этого продукта. Важно отметить, что полученный дрожжевой экстракт мог использоваться бактериями в качестве единственного источника энергии в бактериальных твердых и жидких средах (. и .). Полученный дрожжевой экстракт сравним с тремя коммерческими дрожжевыми экстрактами с точки зрения свойств роста бактерий в среде LB ( и ). Преимущества разработанного нами способа получения дрожжевого экстракта по сравнению с существующими протоколами заключаются в следующем:
и .). Полученный дрожжевой экстракт сравним с тремя коммерческими дрожжевыми экстрактами с точки зрения свойств роста бактерий в среде LB ( и ). Преимущества разработанного нами способа получения дрожжевого экстракта по сравнению с существующими протоколами заключаются в следующем:
i) В процессе экстракции не использовались химические вещества, такие как кислоты, щелочи или соли, что, в свою очередь, устраняет сложности в последующих процессах из-за удаления добавленных реагентов и снижает стоимость производства.
ii) В процессе экстракции фермент не использовался, поэтому конечная стоимость производства будет снижена.
iii) Количество необходимых шагов в процессе экстракции было уменьшено, что ускорило производство экстракции дрожжей по сравнению с другими доступными утомительными и трудоемкими методами.
Таким образом, мы разработали простой, быстрый и рентабельный метод получения дрожжевого экстракта из пекарских дрожжей ( Saccharomyces cerevisiae) . Этот метод можно использовать в исследовательских лабораториях для снижения затрат на исследования и масштабировать для производства больших количеств для промышленных применений, где необходимо культивирование микробов.
Этот метод можно использовать в исследовательских лабораториях для снижения затрат на исследования и масштабировать для производства больших количеств для промышленных применений, где необходимо культивирование микробов.
У авторов нет конфликта интересов.
1. Менсур Н., Маргаритис А., Бриенс С., Пилкингтон Х., Рассел И. Применение иммобилизованных дрожжевых клеток в пивоваренной промышленности. прог. Биотехнолог. 1996;11:661–71. [Google Scholar]
2. Флот GH. Дрожжи в пищевых продуктах и напитках влияют на качество и безопасность продуктов. Курс. мнение Биотехнолог. 2007; 18:170–5. [PubMed] [Google Scholar]
3. Маккар Р.С., ДиНово А.А., Вестуотер С., Шофилд Д.А. Ферментативная биоремедиация фосфорорганических соединений с использованием стабильных дрожжевых биокатализаторов. Дж. Биоремед. Биодег. 2013;4:2. [Google Scholar]
4. Dato L, Branduardi P, Passolunghi S, Cattaneo D, Riboldi L, Frascotti G, Valli M, Porro D. Достижения в области молекулярных инструментов для использования Zygosaccharomyces bailii в качестве хозяина для биотехнологических производств и строительства первый ауксотрофный мутант. FEMS Yeast Res. 2010;10:894–908. [PubMed] [Google Scholar]
FEMS Yeast Res. 2010;10:894–908. [PubMed] [Google Scholar]
5. Делнери Д. Технология штрихового кода в применении дрожжей к фармакогеномике. FEMS Yeast Res. 2010;10:1083–9. [PubMed] [Google Scholar]
6. Салари Р., Раджаби О., Хашьярманеш З., Фатхи Наджафи М., Фазли Баззаз Б.С. Характеристика инкапсулированного берберина в дрожжевых клетках Saccharomyces cerevisiae. Иран Дж. Фарм. Рез. 2015;14:1247–56. [Статья бесплатно PMC] [PubMed] [Google Scholar]
7. Криворучко А., Зиверс В., Нильсен Дж. Возможности метаболической инженерии дрожжей: уроки синтетической биологии. Биотехнолог. Дж. 2011; 6: 262–76. [PubMed] [Академия Google]
8. де Йонг Б., Сиверс В., Нильсен Дж. Системная биология дрожжей. благоприятные технологии для разработки клеточных фабрик для производства передового биотоплива. Курс. мнение Биотехнолог. 2012; 23: 624–30. [PubMed] [Google Scholar]
9. Ferreira I, Pinho O, Vieira E, Tavarela J. Дрожжевая биомасса Saccharomyces Brewer: характеристики и потенциальное применение. Тенденции. Пищевая наука. Технол. 2010;21:77–84. [Google Scholar]
Тенденции. Пищевая наука. Технол. 2010;21:77–84. [Google Scholar]
10. Chae HJ, Joo H, In M-J. Использование клеток пивных дрожжей для производства пищевого дрожжевого экстракта. Часть 1: влияние различных ферментных обработок на восстановление твердого вещества и белка и вкусовые характеристики. Биоресурс. Технол. 2001; 76: 253–8. [PubMed] [Академия Google]
11. Gaudreau H, Renard N, Champagne C, Horn DV. Оценка смесей дрожжевого и картофельного экстрактов в питательной среде для производства биомассы молочнокислых культур. Может. Дж. Микробиол. 2002; 48: 626–34. [PubMed] [Google Scholar]
12. Чжан Дж., Редди Дж., Бакленд Б., Гришам Р. К последовательной и продуктивной комплексной среде для исследований промышленной ферментации дрожжевого экстракта для процесса ферментации рекомбинантных дрожжей. Биотехнолог. биоинж. 2003; 82: 640–52. [PubMed] [Академия Google]
13. Акопян Л., Габриелян Л., Трчунян А. Дрожжевой экстракт как эффективный источник азота, стимулирующий рост клеток и усиливающий фотопродукцию водорода штаммами Rhodobacter sphaeroides из минеральных источников. Междунар. Дж. Водородная энергия. 2012; 37: 6519–26. [Google Scholar]
Междунар. Дж. Водородная энергия. 2012; 37: 6519–26. [Google Scholar]
14. Li X, Li Z, Zheng J, Shi Z, Li L. Дрожжевой экстракт способствует фазовому сдвигу ферментации биобутанола Clostridium acetobutylicum ATCC824 с использованием маниоки в качестве субстрата. Биоресурс. Технол. 2012; 125:43–51. [PubMed] [Академия Google]
15. Кадо Х., Шибата Т., Кобаяши Ф., Кубота М. Способ получения дрожжевого экстракта. Патент WO. 1998 1 998 046 089. [Google Scholar]
16. Revillion JP, Brandelli A, Ayub MAZ. Производство дрожжевого экстракта из сыворотки с использованием Kluyveromyces marxianus. Браз. Арка биол. Технол. 2003;46:121–8. [Google Scholar]
17. Милич Т.В., Ракин М., Шилер-Маринкович С. Использование пекарских дрожжей (Saccharomyces cerevisiae) для производства дрожжевого экстракта: влияние различных ферментных обработок на восстановление твердых веществ, белков и углеводов. Ж. Серб. хим. соц. 2007; 72: 451–7. [Академия Google]
18. Хачия Т., Такашима Х. , Танекава Т. Производство дрожжевого экстракта, содержащего ароматизатор. патент США. 1981 г. 4 303 680 человек. [Google Scholar]
, Танекава Т. Производство дрожжевого экстракта, содержащего ароматизатор. патент США. 1981 г. 4 303 680 человек. [Google Scholar]
19. Potman RP, Wesdorp J. Способ приготовления дрожжевого экстракта, указанный дрожжевой экстракт, его использование в качестве пищевого ароматизатора и пищевая композиция, содержащая дрожжевой экстракт. Патент США. 1994 г. 5 288 509 человек. [Google Scholar]
20. York S, Ingram L. Производство этанола рекомбинантной Escherichia coli KO11 с использованием неочищенного автолизата дрожжей в качестве питательной добавки. Биотехнолог. лат. 1996;18:683-8. [Google Scholar]
21. Ло Ю-М, Ян С-Т, Мин ДБ. Влияние дрожжевого экстракта и глюкозы на продукцию ксантана и рост клеток в периодической культуре Xanthomonas campestris. заявл. микробиол. Биотехнолог. 1997; 47: 689–94. [Google Scholar]
22. Ямал Г., Шармила П., Рао К., Пардха-Сарадхи П. Дрожжевой экстракт маннитоловой среды и ее компоненты способствуют синтезу наночастиц золота. Процесс биохим. 2013;48:532–538. [Google Scholar]
2013;48:532–538. [Google Scholar]
23. Ноордам Б. Способ производства дрожжевых экстрактов с низкой мутностью. Патент США. 2013 20 130 316 047. [Академия Google]
24. Бабаян Т., Безруков М. Автолиз в дрожжах. Акта Биотехнолог. 1985; 5: 129–36. [Google Scholar]
25. Kanegae Y, Sugiyama Y, Minami K. Способ получения дрожжевого экстракта. Патент на ЭП. 1993 г. 0 249 435. [Google Scholar]
26. Origane A, Sato T. Производство дрожжевого экстракта. Патент на ЭП. 1994 г. 0 466 922. [Google Scholar]
27. Калум Л. Способ получения дрожжевого экстракта. Патент на ЭП. 2009 2 097 510. [Google Scholar]
28. Hyoeky G, Sarkki M-l, Tylli M. Способ получения дрожжевого экстракта, пригодного для пищевых продуктов, при котором из экстракта были удалены нежелательные ароматизаторы. Патент на ЭП. 1998 0 871 374. [Google Scholar]
29. Conway J, Gaudreau H, Champagne CP. Влияние добавления протеаз и глюканаз при автолизе дрожжей на продукцию и свойства дрожжевых экстрактов. Может. Дж. Микробиол. 2001; 47:18–24. [PubMed] [Google Scholar]
Может. Дж. Микробиол. 2001; 47:18–24. [PubMed] [Google Scholar]
30. Moench S, Stute R. Процесс производства дрожжевых экстрактов. Патент на ЭП. 2002 г. 1 199 353 человека. [Google Scholar]
31. Харада С., Ито Дж., Яно М., Аояги Ю., Маэкава Х. Дрожжевой экстракт и способ его получения. Патент на ЭП. 1989 0 299 078. [Google Scholar]
Дрожжевой экстракт | Питательная среда
Дрожжевой экстракт
Предмет номер.
NCM0218A
$ 95,55 каждый
$ 907,73 каждый
1777,23 доллара США каждый
4361,86 долларов США каждый
$8,695.05 каждый
$ 95,55 каждый
$ 907,73 каждый
1777,23 доллара США каждый
4361,86 долларов США каждый
8 695,05 долларов США каждый
В наличии
Нет на складе
Ожидайте наличие через 2-4 недели
Выберите варианты продукта500 г5 кг10 кг25 кг50 кг
Минимальное необходимое количество: 1
Этот товар необходимо заказывать кратно одному ящику. Количество в упаковке: 1
Количество в упаковке: 1
Для заказа или получения дополнительной информации свяжитесь с нами
Характеристики
903:30
Документы
Поддерживать
903:30
Дрожжевой экстракт представляет собой автолизат дрожжевых клеток, используемый для приготовления микробиологических питательных сред в лабораторных условиях. Экстракт дрожжей не предназначен для диагностики заболеваний или других состояний у людей.
Экстракт дрожжей не предназначен для диагностики заболеваний или других состояний у людей.
Дрожжевой экстракт представляет собой водорастворимую часть автолизированных дрожжей. Автолиз тщательно контролируется, чтобы сохранить встречающиеся в природе витамины группы В. Экстракт дрожжей приготовлен и стандартизирован для бактериологического использования и клеточных культур и является отличным стимулятором роста бактерий. Экстракт дрожжей обычно используется в концентрации 0,3% — 0,5%. Дрожжевой экстракт обычно готовят путем выращивания пекарских дрожжей Saccharomyces spp. в растительной среде, богатой углеводами. Дрожжи собирают, промывают и ресуспендируют в воде, где они подвергаются автолизу, т. е. самоперевариванию с использованием ферментов дрожжей. Экстракт дрожжей является полностью растворимой частью этого аутолитического действия. Автолитическая активность останавливается этапом нагревания. Полученный дрожжевой экстракт отфильтровывают и сушат в порошок распылительной сушкой.
Экстракт дрожжей оказался успешным в культуральной среде для бактериальных исследований в молоке и других молочных продуктах. Несколько сред, содержащих дрожжевой экстракт, рекомендованы для применения в клеточных культурах.
Несколько сред, содержащих дрожжевой экстракт, рекомендованы для применения в клеточных культурах.
| Технические характеристики | ||
|---|---|---|
| Марка | Питательная среда Neogen® | |
| Аналит | Неселективный | |
| Платформа | Обезвоженные питательные среды | |
| Масса | 500 г | |
| Предыдущий номер позиции | Продукт ранее был известен как Acumedia Product: 7184 Yeast Extract; и лабораторный продукт: порошок дрожжевого экстракта MC001 | |
| Вес упаковки | 1,35 | |
Документы
Чтобы получить доступ к сертификату анализа (COA), воспользуйтесь нашим поиском COA.

