ЛАБОРАТОРНАЯ ДИАГНОСТИКА ДИФТЕРИЙНОЙ ИНФЕКЦИИ. МЕТОДИЧЕСКИЕ УКАЗАНИЯ. МУ 4.2.698-98 (утв. Минздравом РФ 09.01.1998). Мук по дифтерии 2013
МУК 4.2.3065-13 Лабораторная диагностика дифтерийной инфекции
Страница 1 из 63

Страница 2 из 63

Страница 3 из 63

Страница 4 из 63

Страница 5 из 63

Страница 6 из 63

Страница 7 из 63

Страница 8 из 63

Страница 9 из 63

Страница 10 из 63

Страница 11 из 63

Страница 12 из 63

Страница 13 из 63

Страница 14 из 63

Страница 15 из 63

Страница 16 из 63

Страница 17 из 63

Страница 18 из 63

Страница 19 из 63

Страница 20 из 63

Страница 21 из 63

Страница 22 из 63

Страница 23 из 63

Страница 24 из 63

Страница 25 из 63

Страница 26 из 63

Страница 27 из 63

Страница 28 из 63

Страница 29 из 63

Страница 30 из 63

Страница 31 из 63

Страница 32 из 63

Страница 33 из 63

Страница 34 из 63

Страница 35 из 63

Страница 36 из 63

Страница 37 из 63

Страница 38 из 63

Страница 39 из 63

Страница 40 из 63

Страница 41 из 63

Страница 42 из 63

Страница 43 из 63

Страница 44 из 63

Страница 45 из 63

Страница 46 из 63

Страница 47 из 63

Страница 48 из 63

Страница 49 из 63

Страница 50 из 63

Страница 51 из 63

Страница 52 из 63

Страница 53 из 63

Страница 54 из 63

Страница 55 из 63

Страница 56 из 63

Страница 57 из 63

Страница 58 из 63

Страница 59 из 63

Страница 60 из 63

Страница 61 из 63

Страница 62 из 63

Страница 63 из 63

docinfo.ru
ЛАБОРАТОРНАЯ ДИАГНОСТИКА ДИФТЕРИЙНОЙ ИНФЕКЦИИ. МЕТОДИЧЕСКИЕ УКАЗАНИЯ. МУ 4.2.698-98 (утв. Минздравом РФ 09.01.1998)
УтвержденыГлавным государственнымсанитарным врачомРоссийской Федерации -Первым заместителемМинистра здравоохраненияРоссийской ФедерацииГ.Г.ОНИЩЕНКО9 января 1998 годаДата введения - 8 июня 1998 года4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕИ МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫЛАБОРАТОРНАЯ ДИАГНОСТИКА ДИФТЕРИЙНОЙ ИНФЕКЦИИМЕТОДИЧЕСКИЕ УКАЗАНИЯМУ 4.2.698-981. Разработаны сотрудниками Федеральной референс - лаборатории диагностики дифтерийной инфекции Московского научно - исследовательского института эпидемиологии и микробиологии им. Г.Н. Габричевского (д.м.н. Мазуровой И.К., к.м.н. Мельниковым, к.б.н. Комбаровой С.Ю., Борисовой О.Ю.) и Департаментом Госсанэпиднадзора Минздрава России (Жилиной Н.Я.).2. Утверждены и введены в действие главным государственным санитарным врачом Российской Федерации, первым заместителем Министра здравоохранения Российской Федерации от 8 апреля 1998 г.3. Введены взамен Методических указаний 4.2.589-96 "Лабораторная диагностика дифтерийной инфекции".1. Область примененияМетодические указания составлены в помощь специалистам бактериологических лабораторий санитарно - эпидемиологичоской службы, лечебно - профилактических учреждений и научно - исследовательских институтов для совершенствования лабораторной диагностики дифтерийной инфекции.2. Характеристика возбудителя дифтерийной инфекцииВозбудителем дифтерийной инфекции являются токсигенные Corynebacterium diphtheriae. Нетоксигенные коринебактерии дифтерии не вызывают дифтерийную инфекцию. "Этиологическая" значимость этих микроорганизмов при неинфекционной патологии (фарингит, артрит, эндокардит и др.) требует специальных доказательств. При выделении нетоксигенных штаммов С.diphtheriae от больных с подозрением на дифтерийную инфекцию следует обратить внимание на правильность проведения бактериологического исследования и оценку токсигенных свойств.В основе способности С. diphtheriae вырабатывать экзотоксин лежит феномен фаговой (или лизогенной) конверсии. Конверсия нетоксигенных штаммов С. diphtheriae в токсигенные и наоборот воспроизводится только в особых, экспериментальных условиях. В тех случаях, когда при первичном посеве исследуемого материала от больных дифтерией выделяют токсигенные, а при повторных обследованиях после лечения антибиотиками - нетоксигенные коринебактерии дифтерии, можно предположить, что при использовании антибиотиков в первую очередь исчезают токсигенные штаммы, как более чувствительные к их действию, а нетоксигенные штаммы продолжают выделяться. Такое же положение может создаваться и при санации антибиотиками бактерионосителей, одновременно выделяющих токсигенные и нетоксигенные коринебактерии дифтерии. Обнаружение у таких носителей при повторных обследованиях только нетоксигенных штаммов нельзя трактовать как утрату способности штаммов продуцировать экзотоксин.Таксономически близкими виду С.diphtheriae являются C.ulcerans и C.pseudotuberculosis (C.ovis). Данные микроорганизмы - природные патогены крупного и мелкого рогатого скота, лошадей. Отмечена способность этих видов бактерий вырабатывать токсин, подобный дифтерийному. Встречаются и "нетоксигенные" штаммы. Известны случаи выделения "токсигенных" C.ulcerans при клинической картине заболевания, сходной с дифтерией.На слизистых оболочках ротоглотки и носа в норме часто встречается ложнодифтерийная палочка Гофмана (C.pseudodiphtheriticum). Умение выделять и идентифицировать данные бактерии служит критерием оценки качества работы бактериологов в межэпидемический период.Все микроорганизмы рода Corynebacterium являются грамположительными палочками, не образующими спор, обладающими различной степенью полиморфизма. Большинство видов лучше растет в аэробных условиях.Обычно колонии микроорганизмов из рода коринебактерий на плотных питательных средах (например, на кровяном агаре) имеют серовато - белую или желтоватую окраску, непрозрачные или полупрозрачные, округлой формы, диаметром 1 - 3 мм. Чаще всего они бывают мягкой, маслянистой консистенции, хотя некоторые виды рода коринебактерии могут образовывать шероховатые R-колонии. Представители этого рода не отличаются высокой ферментативной активностью. C.diphtheriae растут при 37° C, устойчивы к низкой температуре, чувствительны к высокой. Все дезинфицирующие вещества в обычных концентрациях (3 - 5%) уничтожают коринебактерии дифтерии в течении 20 - 30 минут. Токсигенные C.diphtheriae более чувствительны к антибиотикам, чем нетоксигенные. Возможно появление устойчивых к антибиотикам штаммов. Широко определять чувствительность к антибиотикам штаммов, выделенных от бактерионосителей, не следует из-за несоответствия результатов лабораторной пробы с действием антибиотиков на возбудителя дифтерии в организме человека.Для C.diphtheriae характерен значительный полиморфизм - разнообразие размеров и формы клеток. Клетки имеют форму булавы, ракетки, овода и т.д. Взаиморасположение клеток напоминает римские цифры X, V. При окраске часто обнаруживается выраженная внутриклеточная исчерченность, что объясняется наличием зерен волютина. Описано сродство волютина к метиленовому синему и, при обработке этим красителем, гранулы или полоски (скопления гранул) прокрашиваются в синий цвет, а протоплазма в отдельных случаях может приобрести розовый оттенок. Использование в бактериологической практике окраски по Граму является нецелесообразным, поскольку клетки C.diphtheriae легко обесцвечиваются спиртом и могут выглядеть в мазке грамвариабельными или даже грамотрицательными.Для C.ulcerans и C.pseudodiphtheriticum характерна склонность к параллельному расположению клеток. 24 - 48-часовые культуры этих видов имеют чаще всего овоидную форму клеток.По форме колоний и некоторым биохимическим свойствам C.diphtheriae подразделяют на культурально - биохимические варианты - gravis, mitis, intermedius.Через 48 - 72 часа роста вариант mitis образует колонии S-типа - гладкие, диаметром 1 - 2 мм; S-R-колонии варианта gravis обычно выпуклые, с приподнятым центром, диаметром 2 - 3 мм; колонии варианта intermedius - S-типа, мелкие, плоские, гладкие, с ровным краем, диаметром 0,5 - 1 мм. Далее описываются только два культурально - биохимических варианта - gravis и mitis, так как биовар intermedius встречается редко и по биохимическим свойствам не отличается от биовара mitis.На кровяных теллуритовых средах через 48 часов роста колонии C.diphtheriae варианта gravis, как и колонии C.ulcerans, черные, матовые имеют радиальную исчерченность. Колонии C.pseudodiphtheriticum имеют характерный светлый ободок.В бактериологической практике опираться только на морфологические свойства колоний или микробной клетки, при идентификации C.diphtheriae, не представляется возможным. Описаны случаи бактериологической гипо- и гипердиагностики (в 55% и 14,5% случаев соответственно), когда используется учет только морфологических признаков. При идентификации C.diphtheriae необходимо использовать комплекс тестов, в первую очередь, определение патогенности (токсигенности), основного признака возбудителя дифтерии.Определение токсигенных свойств проводится бактериологами в первые сутки роста подозрительных колоний на чашках первичного посева материала. Во избежание ошибок при определении токсигенных свойств коринебактерий, необходимо изучать данный признак у максимального числа выросших колоний с чашек первичного посева. При соблюдении описанных ниже методик можно изучить токсигенность более чем у 20 подозрительных колоний из одного анализа. Нельзя изучать материал при множественном росте подозрительных колоний только в одной - двух бляшках.Ферментативная активность микроорганизмов изучается путем определения ферментов цистиназы, уреазы, способности расщеплять до кислоты глюкозу, сахарозу, крахмал. В редких случаях, когда необходимо идентифицировать C.ulcerans, добавляется тест на восстановление нитратов в нитриты.Учитывая, что при идентификации возбудителя дифтерийной инфекции ведущим элементом является определение наличия токсина, оценки других свойств имеет вспомогательное значение. Использование "длинного" углеводного ряда является излишним при идентификация C.diphtheriae. Практическим бактериологам, занимающимся лабораторной диагностикой дифтерии, не требуется проводить идентификацию до вида других микроорганизмов рода Corynebacterium. В то же время, в лабораториях, где проводится диагностика заболеваний, вызываемых "недифтерийными" коринебактериями, недостаточно использования даже "длинного" углеводного ряда. Для точной идентификации данных микроорганизмов необходимо использовать хемотаксономические методы исследования, например, такие, как определение наличия миколовых кислот в составе клеточной стенки бактерий и некоторые другие.Таким образом, выделенный микроорганизм является возбудителем дифтерии, если он обладает токсигенными свойствами, определенным спектром ферментативной активности (расщепление глюкозы, крахмала, отсутствие разложения сахарозы, наличие фермента цистиназы, отсутствие фермента уреазы) и характерными морфолого - культуральными признаками (образование колоний черного или серого цвета на кровяно - теллуритовых средах, с учетом, при необходимости, морфологии клеток - полиморфные, не образующие спор палочки).3. Бактериологическое исследованиеБактериологическое исследование проводят с целью лабораторной диагностики дифтерийной инфекции, выявления источников инфекции и наблюдения за распространенностью токсигенных коринебактерии дифтерии.ВЗЯТИЕ И ДОСТАВКА МАТЕРИАЛА1. Успех бактериологического исследования в значительной степени зависит от своевременного и правильного взятия материала.2. Взятие материала должны производить специально обученные медицинские работники лечебно - профилактических учреждений.3. При исследовании на дифтерию обследуют ротоглотку и нос. При дифтерии редких локализаций (глаз, ухо, рана, кожа, влагалище) помимо пораженных участков, следует брать материал также с миндалин и из носа.4. Взятие материала осуществляют с помощью стерильных ватных сухих тампонов. Для их приготовления используют деревянные или металлические (из нержавеющего металла) палочки, на один из концов которых плотно накручивается слой гигроскопической ваты (примерно 120 мг ваты на тампон). Тампоны должны иметь форму "капли", а не "веретена". Тампоны монтируют в пробирки с корковыми или ватными пробками так, чтобы конец тампона не касался дна и стенок пробирки. Стерилизуют тампоны в сухожаровом шкафу при температуре 140° C в течение часа или в автоклаве при 0,5 атм. 30 мин.5. Материал из ротоглотки и носа берут отдельными тампонами, натощак или не ранее, чем через два часа после еды, при хорошем освещении, с использованием шпателя, не касаясь тампоном языка и внутренних поверхностей щек и зубов. Одним тампоном собирают материал с пораженных участков ротоглотки - миндалин, а при необходимости - с дужек мягкого неба, небного язычка или задней стенки глотки. При наличии налетов, материал следует брать с границы пораженных и здоровых тканей, слегка нажимая на них тампоном. Для взятия материала из носа используют другой тампон, который вводят сначала в один, а потом в другой носовой ход, не касаясь крыльев носа снаружи.6. При ларингоскопии материал (слизь, пленка) собирают непосредственно из гортани. Материал с пораженных участков кожи следует собирать сухим тампоном после удаления корочек или струпа.7. Тампоны должны быть доставлены в лабораторию не позднее 3-х часов с момента взятия материала. При проведении обследования контингентов в отдаленных от бактериологических лабораторий районах, рекомендуется засевать материал на чашки с питательной средой или использовать транспортную среду.8. В случае использования транспортной среды материал собирают сухим тампоном, опускают в пробирку со средой и следят за тем, чтобы пробка тампона не намокла. Следует учитывать, что применение транспортной среды увеличивает срок выдачи окончательного ответа на одни сутки.9. Чашки (или пробирки с транспортной средой) с посевом исследуемого материала можно поместить для подращивания в термостат при 37° C на 15 - 18 часов, после чего доставить в лабораторию.10. При транспортировке на дальние расстояния также можно использовать тампоны, предварительно пропитанные раствором глицерина. Тампон пропитывают 5-процентным раствором глицерина в дистиллированной воде, отжимают о стенки сосуда с раствором, укрепляют в пробирке так же, как сухой тампон и автоклавируют при 0,5 атм. в течение 30 мин.11. Холодное время года исследуемый материал доставляют в баклабораторию в сумках - термосах, во избежание его замерзания.12. В случае необходимости проведения постмортальных исследований на коринебактерии дифтерии, материал целесообразно брать с миндалин, гортани и полости носа, поскольку во внутренних органах возбудитель обнаруживается редко.13. Каждой пробирке с исследуемым материалом (зев, нос или другая локализация) придается номер. В прилагаемом списке указывается номер пробирки, фамилия, имя (или инициалы), возраст, название учреждения, направляющего материал, или домашний адрес обследуемого, цель обследования (диагностическая с указанием диагноза, по эпидпоказаниям, профилактическое обследование), дата и время взятия материала.ХОД ИССЛЕДОВАНИЯ. ПЕРВЫЙ ДЕНЬПосев материала.Материал для исследования из ротоглотки, носа или других пораженных мест засевают раздельно на поверхность одной из рекомендуемых плотных питательных сред, разлитых в чашки Петри.Посев от одного лица производят на одну чашку, используя при этом половину поверхности среды для посева материала из ротоглотки, а вторую - для посева материала из носа. При посеве материала с кожи или других мест добавляют еще одну чашку. Не допускается посев материала от нескольких лиц на одну чашку.При посеве материал втирают в среду со всех сторон тампона на участке площадью 2 x 1 кв. см - формирование такой "площадки" является обязательным. Затем этим же тампоном засевают оставшуюся поверхность 1/2 чашки. Посев производят частыми неперекрывающимися штрихами, не отрывая тампон от поверхности питательной среды и не изменяя положения тампона. Такой метод посева позволяет засеять весь материал с тампона, получить изолированные колонии (чистую культуру) для дальнейшей идентификации непосредственно на чашке первичного посева, что сокращает длительность анализа на одни сутки. Засеянные чашки или пробирки с транспортной средой помещают в термостат при 37° C. Высев из транспортной среды производят на следующие сутки на плотную питательную среду тампоном, отжатым о стенки пробирки, или петлей, забирая материал из осадка.Посев следует производить на чашки со средой, согретые при комнатной температуре или в термостате (15
ПОСТАНОВЛЕНИЕ Госкомстата РФ от 09.01.1998 n 2 ОБ УТВЕРЖДЕНИИ УНИФИЦИРОВАННОЙ СИСТЕМЫ ПОКАЗАТЕЛЕЙ, ХАРАКТЕРИЗУЮЩИХ СОЦИАЛЬНО-ЭКОНОМИЧЕСКОЕ ПОЛОЖЕНИЕ МУНИЦИПАЛЬНОГО ОБРАЗОВАНИЯ »
Постановления и Указы »
www.lawmix.ru
Диагностика дифтерии. Фото
Диагностика дифтерии основана на клинических данных с последующим подтверждением диагноза бактериологическим исследованием. Лабораторная диагностика дифтерии включает в себя ряд исследований, основным из которых является микробиологическое.
- Зачастую для постановки диагноза бывает достаточно тщательно собранного анамнеза заболевания и осмотра ротоглотки. Всякая задержка при установлении диагноза и назначения адекватного лечения увеличивает вероятность неблагоприятного исхода заболевания.
- Выделение культуры возбудителей с последующим определением у выделенных возбудителей токсикогенности является основным и единственным методом микробиологической диагностики дифтерии. Предварительный результат получается через 24 часа, через 48 часов получается результат исследования дифтерийных палочек на токсикогенность, через 72 часа определяется биовар возбудителя.
- Микроскопическое исследование при дифтерии нерационально.
- Серологическая диагностика основана на определении роста титра антибактериальных антител. Результаты получаются на 2-й неделе заболевания.
- При диагностике дифтерии применяется генетический метод (ПЦР), позволяющий определить ДНК бактерий.
- Реакция латекс агглютинации относится к экспресс-методам. Результат получается уже через два часа.
- Иммунофлуоресцентный анализ результативен. Однако его проведение должно осуществляться только высококвалифицированным персоналом.

Рис. 1. Пленка грязно-белого цвета и выраженный отек подкожной жировой клетчатки шеи — «бычья шея» — классические признаки дифтерии.
Микробиологическая диагностика дифтерии
Микробиологическое исследование является основным методом лабораторной диагностики дифтерии.
Методика посева на питательные среды
В каких случаях проводится бактериологическое исследование
Бактериологическое исследование проводится в следующих случаях:
- с целью диагностики дифтерии зева, носа и глотки у взрослых и детей,
- с целью выявления возможного бактерионосительства у лиц, которые поступают в детские дошкольные учреждения и специализированные учреждения для взрослых,
- с целью выявления заболевания среди контактирующих лиц.
Материал для исследования
Материал для исследования (мазок на дифтерию) собирается натощак или спустя 2 часа после еды. Для исследования используются дифтерийные пленки или кусочки тканей, расположенных по соседству, отделяемое из мест поражения и носоглоточная слизь.
Методика забора материала
Забор материала (мазок на дифтерию) осуществляется ватным тампоном. Корень языка прижимается шпателем. Ватным тампоном необходимо коснуться слизистой оболочки миндалин на границе пленки, дужек и задней стенки глотки. Далее тампон опускается в стерильную пробирку, не касаясь ее стенок.
В течение первых 3-х часов должен быть отправлен в лабораторию. При невозможности произвести посев в ближайшие 3 — 4 часа, забор материала осуществляется стерильным ватным тампоном, который смачивают в 5% растворе глицерина в изотоническом растворе хлорида натрия или 2% растворе теллурита калия.
Забор материала (мазок на дифтерию) осуществляется двумя ватными тампонами, один из которых используется для посева, другой — для микроскопии.
При подозрении на дифтерию необходимо оповестить сотрудников лаборатории, чтобы собранный материал был посеян на соответствующие среды (кровяной агар, среда Леффлера или теллуритовая среда).
Культивирование бактерий дифтерии
Посев осуществляется на питательные среды (кровяной агар, среда Леффлера или теллуритовая среда). Теллурит в большой концентрации подавляет рост сопутствующей микрофлоры.

Рис. 2. На фото рост колоний палочки дифтерии на разных средах — кровяном агаре и теллуритовой среде.
При росте бактерий на кровяном агаре колонии приобретают беловатую окраску, они непрозрачные, округлые, выпуклой формы, 1 — 2 мм в диаметре, чаще маслянистой консистенции.
При росте бактерий на теллуритовых средах колонии серого цвета, выпуклые, края ровные. Через двое суток колонии приобретают темно-серый или черный цвет, они имеют металлический блеск, ровные или фестончатые края, поверхность гладкая или радиально исчерчена.
Идентификация биотипа (разновидности штамма) дифтерии
Идентификации разновидностей штаммов возбудителей дифтерии основана на способности бактерий расщеплять гликоген и крахмал. Для этих целей используется методика «длинного» ряда углеводов.
Принимая во внимание ферментативные признаки возбудителей и структуру колоний при росте на теллуритовых средах, выделяют 4 биотипа коринебактерий дифтерии: Corynebacterium diphtheriae gravis, Corynebacterium diphtheriae mittis, Corynebacterium diphtheriae intermedius и Corynebacterium diphtheriae belfanti.

Рис. 3. На фото слева колонии коринебактерий дифтерии гравис (Corynebacterium diphtheriae gravis). Они имеют большой размер, выпуклые по центру, радиально исчерчены, с неровными краями. На фото справа Corynebacterium diphtheriae mittis. Они небольшого размера, темной окраски, гладкие и блестящие, с ровными краями.
Определение токсикогенности дифтерийных палочек
Токсикогенность возбудителей дифтерии определяется после выделения культуры бактерий. Для этих целей используется методика диффузной преципитации в геле и методика определения токсикогенности бактерий в живом организме (на морских свинках).
Методика бактериоскопии
Лабораторная диагностика с применением микроскопии является второстепенным по значимости. Ввиду того, что возбудители дифтерии плохо впитывают красители, окраска по Граму считается не специфичной, однако она позволяет косвенно определить непатогенные коринебактерии, которые в мазке располагаются параллельно друг другу.
При окраске по Нейссеру выявляются характерные для дифтерийных палочек зерна Бабеша-Эрнста, которые располагаются на полюсах клеток, придавая им вид булавы.
В мазках патогенные дифтерийные палочки располагаются под углом друг к другу.
Для выявления зерен Бабеша-Эрнста применяется методика люминесцентной микроскопии. При окрашивании мазков корифосфином в микроскопе можно увидеть желто-зеленые тела бактериальных клеток с оранжево красными зернами волютина.

Рис. 4. Дифтерийные палочки под микроскопом. Окраска по Граму.

Рис. 5. На фото слева ложнодифтерийные палочки Гоффмана. Они часто обнаруживаются в носоглотке. Они толстые, короткие, располагаются в мазках параллельно друг другу. На фото справа патогенные бактерии. В мазке располагаются под углом друг к другу.
к содержанию ↑Серологическая диагностика дифтерии
Серологические исследования позволяют обнаружить антибактериальные и антитоксические антитела. Значимым является обнаружение антибактериальных антител, так как содержание антитоксина изменяется в связи с применением с первых дней антитоксической сыворотки. Наиболее распространенными в настоящее время является реакция пассивной гемагглютинации (РНГА и РПГА).
Иммуноглобулины G и M говорят об остроте инфекционного процесса.
Иммуноглобулины G говорят о недавно перенесенном заболевании.
Иммуноглобулины М говорят об остропротекающей дифтерии.
При дифтерии титр антител со временем повышается. Понижение концентрации антител свидетельствует о выздоровлении больного.
Противодифтерийные антитела образуются после вакцинации. В крови привитого человека они циркулируют многие годы.
к содержанию ↑Диагностика дифтерии с помощью иммунофлуоресцентного анализа
microbak.ru
Лабораторная диагностика дифтерийной инфекции [Текст] : 4.2. Методы контроля. Биологические и микробиологические факторы : методические указания МУК 4.2.3065-13 : [издание официальное]
Поиск по определенным полям
Чтобы сузить результаты поисковой выдачи, можно уточнить запрос, указав поля, по которым производить поиск. Список полей представлен выше. Например:author:иванов
Можно искать по нескольким полям одновременно:author:иванов title:исследование
Логически операторы
По умолчанию используется оператор AND. Оператор AND означает, что документ должен соответствовать всем элементам в группе:исследование разработка
author:иванов title:разработка
оператор OR означает, что документ должен соответствовать одному из значений в группе:исследование OR разработка
author:иванов OR title:разработка
оператор NOT исключает документы, содержащие данный элемент:исследование NOT разработка
author:иванов NOT title:разработка
Тип поиска
При написании запроса можно указывать способ, по которому фраза будет искаться. Поддерживается четыре метода: поиск с учетом морфологии, без морфологии, поиск префикса, поиск фразы. По-умолчанию, поиск производится с учетом морфологии. Для поиска без морфологии, перед словами в фразе достаточно поставить знак "доллар":$исследование $развития
Для поиска префикса нужно поставить звездочку после запроса:исследование*
Для поиска фразы нужно заключить запрос в двойные кавычки:"исследование и разработка"
Поиск по синонимам
Для включения в результаты поиска синонимов слова нужно поставить решётку "#" перед словом или перед выражением в скобках. В применении к одному слову для него будет найдено до трёх синонимов. В применении к выражению в скобках к каждому слову будет добавлен синоним, если он был найден. Не сочетается с поиском без морфологии, поиском по префиксу или поиском по фразе.#исследование
Группировка
Для того, чтобы сгруппировать поисковые фразы нужно использовать скобки. Это позволяет управлять булевой логикой запроса. Например, нужно составить запрос: найти документы у которых автор Иванов или Петров, и заглавие содержит слова исследование или разработка:author:(иванов OR петров) title:(исследование OR разработка)
Приблизительный поиск слова
Для приблизительного поиска нужно поставить тильду "~" в конце слова из фразы. Например:бром~
При поиске будут найдены такие слова, как "бром", "ром", "пром" и т.д. Можно дополнительно указать максимальное количество возможных правок: 0, 1 или 2. Например:бром~1
По умолчанию допускается 2 правки.Критерий близости
Для поиска по критерию близости, нужно поставить тильду "~" в конце фразы. Например, для того, чтобы найти документы со словами исследование и разработка в пределах 2 слов, используйте следующий запрос:"исследование разработка"~2
Релевантность выражений
Для изменения релевантности отдельных выражений в поиске используйте знак "^" в конце выражения, после чего укажите уровень релевантности этого выражения по отношению к остальным. Чем выше уровень, тем более релевантно данное выражение. Например, в данном выражении слово "исследование" в четыре раза релевантнее слова "разработка":исследование^4 разработка
По умолчанию, уровень равен 1. Допустимые значения - положительное вещественное число.Поиск в интервале
Для указания интервала, в котором должно находиться значение какого-то поля, следует указать в скобках граничные значения, разделенные оператором TO. Будет произведена лексикографическая сортировка.author:[Иванов TO Петров]
Будут возвращены результаты с автором, начиная от Иванова и заканчивая Петровым, Иванов и Петров будут включены в результат.author:{Иванов TO Петров}
Такой запрос вернёт результаты с автором, начиная от Иванова и заканчивая Петровым, но Иванов и Петров не будут включены в результат. Для того, чтобы включить значение в интервал, используйте квадратные скобки. Для исключения значения используйте фигурные скобки.search.rsl.ru
7. Коринебактерии. Лабораторная диагностика дифтерии.
Род Corynebarteriurn (от лат. Сoryne - булава) – Гр+ палочковидные бактерии, длиной 1–8 мкм и шириной 0,3–0,8 мкм, не образующие спор, не имеющие жгутиков. Содержат зерна волютина, расположенные чаще всего на концах палочек, они часто превышают размеры поперечника бактерии и придают вид булавы. Также имеются включения липидов и крахмала, который откладывается при недостатке кислорода.
В состав клеточной стенки входят специфические только для бактерий рода Corynebacterium липиды: эфиры коринемиколовой и коринемиколиновой кислот, димикола, фосфатиды маннозы и инозита.
В организме человека обитают условно-патогенные: С.diphtheriae, С.pseudodiphtheriticiim (hofmanii), С.xerosis, С.ulcerans. С.diphtheriae вызывает у человека дифтерию, другие являются возбудителями вторичных инфекций.
КОРИНЕБАКТЕРИЙ ДИФТЕРИИ С.diphtheriae.
Морфология. Прямые или слегка изогнутые палочки. В препаратах располагаются под углом друг к другу в виде букв L, V или китайских иероглифов. Зерна волютина (на концах палочек) выявляются при окраске синькой Леффлера или по методу Нейссера. Факультативные анаэробы, хорошо размножаются при свободном доступе кислорода. К питательным средам требовательны: не способны утилизировать азот из аммонийных соединений, требуют наличия почти всех АК, солей Mg, Zn, Cu, Fe; необходимы углеводы Þ используются среды, полученные на основе ферментативного расщепления белка (казеина, дрожжей) с добавлением крови или сыворотки. На поверхностях плотных сред дифтерийные палочки образуют темно-серые или черные колонии (биовары гравис, способны расщеплять крахмал, или миттис). Рост на скошенном сывороточном агаре сравнивают с шагреневой кожей, колонии не сливаются.
Расщепляют глюкозу и другие моно- и дисахариды с образованием кислоты без газа, восстанавливают нитраты, расщепляют цистеин.
Лизируются специфичны для отдельных видов вирулентными фагами, что позволяет устанавливать фаговары исследуемых культур.
АГ. Имеют белковую капсулу, которая содержит К-АГ. Определение этого АГа позволяет установить серовар (их более 10). Группоспецифический полисахарид АГ клеточной стенки дает перекрестные реакции с микобактериями, нокардиями.
Экология и распространение. Передается аэрозольным (воздушно-капельным) путем. В настоящее время часто регистрируется у взрослых (тяжелая формы). Токсигенность связана лизогенизацией специфическим профагом. Выделяясь в окружающую среду со слюной, пленками, дифтерийные палочки сохраняют жизнеспособность в течение нескольких дней. Хорошо переносят высыхание. Чувствительны к дезинфицирующим растворам, антибиоткам.
Патогенность и патогенез. Заболевание развивается у лиц, не имеющих антитоксического иммунитета. На месте внедрения (зев, гортань, трахея, реже – нос, ухо) развивается местный воспалительный процесс. Все патогенные виды обладают фимбриями Þ АДГЕЗИЯ к клеткам хозяина, они выявляются в РА трипсинизированных бараньих эритроцитов.
Токсигенность – способность секретировать гистотоксин, что проявляется в виде локальной воспалительной реакции и в общей интоксикации организма, особенно чувствительны к нему надпочечники, миокард, НС. Токсин блокирует синтез белка, что приводит к гибели клеток, возникает некроз и летальный исход.
Ферменты (гиалуронидаза, нейраминидаза,фибринолизин) обеспечивают распространение в тканях, но бактериемия клинически не проявляется.
Корд-фактор нарушает фосфорилирование и дыхание клеток микроорганизмов.
Иммунитет. Наиболее восприимчивы дети 1–4 лет. Вырабатывается не очень прочный антитоксический иммунитет, возможны повторные заболевания дифтерией. Невосприимчивость зависит главным образом от содержания в крови антитоксина и АТ (опсонины, преципитины, комплементсвязывающие). Уровень антитоксического иммунитета устанавливают, определяя в крови антитела в РНГА с эритроцитарным диагностикумом (эритроциты нагружены дифтерийным анатоксином). Титр 1:20 и выше Þ иммунность обследуемого. Такжеже применяется реакция Шика (внутрикожно вводят дифтерийный токсин, у неимунных людей – местная воспалительная реакция, при наличии антитоксина реакции нет).
Лабораторная диагностика. В диагностике дифтерии важное значение имеет микроскопический метод. Мазки из налетов зева и носа окрашивают метиленовым синим, по Нейссеру и Граму. Одновременно материал засевают на элективную и дифференциально–диагностическую среды. Выделив культуру, ее идентифицируют по культурально–биохимическим признакам. Затем определяют токсигенность, испытывая культуру на морских свинках или в реакции преципитации на пластинчатом фосфатно–пептонном агаре, подсевая ее бляшками к расположенной вдоль чашки полоске фильтровальной бумаги, смоченной антидифтерийной сывороткой.
Токсигенные штаммы коринебактерии дифтерии при внутрикожном введении вызывают местный некроз, а при подкожном – гибель животных с экссудацией в серозные полости и резкое увеличение надпочечников. Положительная реакция преципитации в агаре проявляется образованием на границе взаимодействия антитоксина и продуцируемого экзотоксина равномерно сливающихся полос преципитации или «стрел–усиков».
Экспресс–диагностика. Если прямой микроскопией мазков, окрашенных обычными способами, выявить коринебактерии дифтерии в материале не удается, то его берут тампоном со свернутой сывороткой (метод Фольгера). Тампон помещают в термостат для подращивания культуры и через 3–5 ч им делают мазки.
Профилактика и лечение. Для профилактики дифтерии используют адсорбированную коклюшно–дифтерийно–столбнячную вакцину (АКДС), содержащую в 1 мл 20 млрд микробных тел палочек коклюша, 30 АЕ (антигенные единицы) дифтерийного анатоксина, 10 АЕ столбнячного анатоксина. Вакцинацию начинают с 5–6–месячного возраста. Курс иммунизации состоит из трех внутримышечных инъекций по 0,5 мл препарата с интервалом 30–40 дней. Ревакцинацию проводят в 3 года, 6 и 11 лет. По эпидемическим показаниям вакцинируют все население, даже людей старше 50 лет.
Специфическое лечение проводится лошадиной антитоксической иммунной сывороткой, которую вводят дробно по методу Безредки в зависимости от тяжести заболевания в количестве от 10 000 до 250 000 АЕ Антибиотики и сульфаниламиды сокращают сроки бактериовыделения у реконвалесцентов и санируют организм здоровых бактерионосителей. Для этих целей назначают пенициллины, тетрациклины, эритромицин.
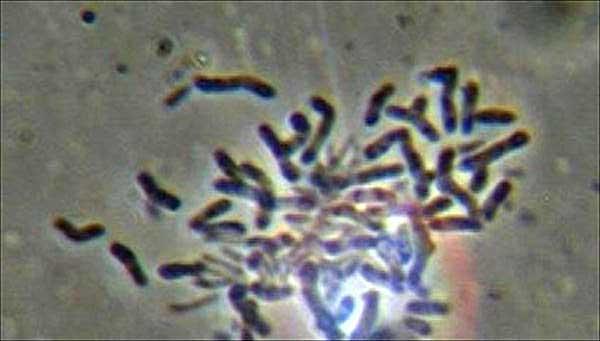
studfiles.net
Коринебактерии дифтерии и дифтерия - Микробиология
ссылкиКоринебактерии дифтерии
Впервые описана Э. Клебсом в 1983 г. и выделена Ф. Леффлером в 1984 г.Морфология и физиология
Коринебактерии дифтерии имеют характерную для всего рода форму. Они располагаются под углом друг к другу в виде римских пятерок. Зерна волютина выявляются при окраске уксуснокислой синькой по методу Нейссера, которая окрашивает только включения, не затрагивая цитоплазму. Дифтерийная палочка окружена микрокапсулой и имеет пили. С. diphtheriae требовательны к питательному субстрату. Они нуждаются во многих аминокислотах, углеводах, минеральных солях. Обычно их культивируют на свернутой сыворотке крови и на кровяном агаре с теллуритом калия. На последней среде образуют колонии двух типов: gravis - темно-серого цвета и mitis - черного цвета, которые отличаются друг от друга и по биохимическим признакам.Антигены
С. diphtheriae содержат в микрокапсуле К-антиген, позволяющий дифференцировать их на серовары и групоспецифический полисахаридный антиген клеточной стенки, который дает перекрестные серологические реакции с микобактериями и нокардиями. Патогенность и патогенез. Факторы вирулентности дифтерийных бактерий - пили и микрокапсула, с помощью которых они прикрепляются к эпителиоцитам миндалин, реже гортани, трахеи, полости носа, конъюнктивы глаза, вульвы. Затем происходит колонизация эпителиоцитов, что сопровождается возникновением воспалительного процесса. Токсичность связана с секрецией гистотоксина, который состоит из двух субъединиц: токсического полипептида и транспортного полипептида, ответственного за доставку токсического компонента к клеткам-«мишеням». Образование первого контролируется бактериальными генами, второго - генами фага, лизогенизировавшего бактериальную клетку. Это свидетельствует о том, что только лизогенные клетки С. diphtheriae могут секретировать гистотоксин.Фиксация гистотоксина происходит на рецепторах мембран мышечных клеток сердца, паренхимы сердца, почек, надпочечников, нервных ганглиев. При этом блокируется синтез белка на рибосомах, что, в конечном итоге, приводит к гибели клеток. При дифтерии, как правило, отсутствует бактериемия и септицемия в связи с локализацией С. diphtheriae в клетках гортани, где развивается фибринозно-некротическое воспаление с образованием пленок, лимфаденита и отеков, что может привести к асфиксии. Кроме дифтерии гортани С. diphtheriae вызывает дифтерию раневых поверхностей и половых органов. К дифтериеподобным коринебактериям относятся следующие: С. xerosis вызывает хронические конъюнктивиты, С. ulcerans - легкие формы дифтериеподобных заболеваний, С. pyogenes и С. haemolyticum - язвенно-некротические фарингиты, тонзиллиты, гингивостоматиты. С. pseudodyphtheriae является постоянным обитателем кожи и слизистых.Иммунитет
Напряженность постинфекционного иммунитета при дифтерии обусловлена высоким уровнем антитоксина в сыворотке крови. Образующиеся при дифтерии антибактериальные антитела - агглютинины, преципитины и другие - не обладают протективными свойствами. О наличии или отсутствии антитоксического иммунитета судят по реакции Шика - нейтрализации токсина антитоксином. При введении V40 DLM дифтерийного токсина в кожу предплечья появляется покраснение и припухание в случае отсутствия антитоксина в крови. При наличии антитоксина реакция Шика отрицательная.Экология и эпидемиология
Средой обитания для С. diphtheriae являются люди, в зеве которых они локализуются. Главным образом дифтерией болеют дети. Однако за последние 30 лет дифтерия «повзрослела». У взрослых дифтерия протекает тяжело и может закончиться летальным исходом. В окружающей среде бактерии дифтерии сохраняют жизнеспособность в течение нескольких дней, поскольку они переносят высушивание. Заражение происходит воздушно-капельным и реже контактным путем.Дифтерия
Дифтерия - острая, преимущественно детская инфекционная болезнь, которая проявляется характерным фибринозным воспалением в месте локализации возбудителя и сильной интоксикацией организма дифтерийными экзотоксин. Возбудителем ее является Corynebacterium diphtheriae, принадлежащего к роду коринебактерий. До этого рода входит еще около 20 видов бактерий, патогенных для людей, животных и растений. Из них наибольшее значение для практической медицины имеют следующие:1. С. ulcerans - может вызвать фарингит, поражение кожи, ее выявляют и у здоровых людей, в молочных продуктах и таре для их перевозки, некоторые штаммы токсигенные.2. С. jeikeium (ранее коринебактерии JK) - влечет пневмонию, эндокардит, перитонит, инфицирует раны, кожу.3. С. cistitidis (ранее коринебактерии группы D2) - инициирует образование камней в мочевыводящих путях и пневмония.4. С. minutissimum - вызывает эритразмы, абсцессы легких, эндокардит.5. С. haemolyticum - может вызвать тонзиллиты, целлюлит, абсцессы мозга, остеомиелит, хронические дерматиты.6. С. xerosis - раньше считали возбудителем ксероза (хронического конъюнктивита), теперь ее относят к сапрофитов.7. С. pseudodiphtheriticum - сапрофит, проживает на слизистой оболочке носоглотки человека.Взятие и доставка материала в лабораторию
Материалом для исследования пленка из миндалин, дужек, неба, язычка, слизь из зева и носа, реже выделения из глаза, уши, раны, влагалища, пораженного участка кожи. По требованию эпидемиолога исследуют смывы с игрушек и других предметов, некоторые пищевые продукты (молоко, мороженое). Материал нужно брать до начала этиотропного лечения натощак или через 2 ч после приема пищи.Для взятия материала используют тампоны, сухие или предварительно смоченные 5% раствором глицерина, помещенные в пробирку и простерилизованные вместе с ней. Исследуемый материал из ротоглотки и носа берут двумя отдельными тампонами, пытаясь взять его на границе здоровой и пораженной области вращательными движениями, не касаясь тампоном слизистой щек, зубов и языка, который прижимают шпателем. При ларингоскопии пленку или слизь берут непосредственно из гортани. Пленки и слизь изо рта и носа берут обязательно во всех случаях, даже при дифтерии редких локализаций (кожа, рана, глаз, ухо, вульва).Если необходимо провести первичную бактериоскопию по требованию врача, материал берут отдельным (дополнительным) тампоном или направляют часть отснятой пленки, тщательно растертой между двумя предметными стеклами.Тампоны после забора материала помещают в те же пробирки, на которых надписывают номер, дату и время отбора, фамилия врача. Они должны быть доставлены в лабораторию не позднее 3-х часов после взятия материала. Если схема забора предусматривает занял у постели больного, то пробирки и чашки с посевами немедленно направляют в лабораторию или инкубируют при 37 ° С и доставляют через 20-23 ч, в холодное время в сумках с грелками.Бактериоскопическое исследование
Бактериоскопическое исследование материала от больного проводят только по требованию врача и только для того, чтобы распознать некротическую ангиной Симановского-Плаута-Венсана (выявление веретенообразных палочек и спирохет Венсана, которые при обычных методах культивирования не растут).На протяжении многих лет микроскопическое исследование и выявление зерен волютина, окрашенных по методам Леффлера и Нейссера, было основой лабораторной диагностики дифтерии и выявления бактерионосительства. Теперь, в связи с изменчивостью дифтерийных бактерий под воздействием антибиотиков, первичная микроскопия исследуемого материала не рекомендуется.Бактериоскопическое исследование проводится с целью идентификации нетипичных колоний на кровяно-телуритових средах и при проверке чистоты выделенных культур. Мазки окрашивают по Граму, Леффлером и Нейссером. Можно красить их уксуснокислым метиловым фиолетовым, толуидиновым синим или бентиазоловим и тиазиновых красителей.Дифтерийные палочки в мазках располагаются под углом, в виде латинских букв V, X, Y, или образуют скопления, напоминающие кучку разбросанных спичек. Волютина зерна располагаются, как правило, на полюсах микробных клеток. Псевдодифтерийни бактерии и дифтероиды размещаются параллельно (в виде "частокола") и, конечно, не имеют зерен волютина. Зерна Бабеша-Эрнста можно обнаружить с помощью люминесцентной микроскопии при окраске мазков корифосфином. Зерна приобретают оранжево-красного цвета на фоне желто-зеленых тел бактериальных клеток.Бактериологическое исследование
Клинический материал засевают на кровяной агар и кровяно-телуритовий агар (или среду Клауберга II), разлитые в чашки Петри. Посев на кровяной агар необходим для обнаружения и другой микрофлоры. Кроме того, некоторые штаммы Cdiphtheriae чувствительны к действию теллурита калия, поэтому их рост на телуритових средах может подавляться. Для выявления дифтерийного бактерионосительства посевы делают только на кровяно-телуритовий агар, поскольку в посевном материале может содержаться небольшое количество дифтерийных палочек, рост которых на неселективных средах будет подавляться другой микрофлорой. При этом допускается использование и транспортной среды.Кровяно-телуриновий агар
К 100 мл 2% расплавленного и охлажденного до 50 ° С питательного агара рН 7,6 добавляют 10-15 мл дефибринированной крови и 2 мл 2% раствора теллурита калия. Смесь тщательно перемешивают и разливают в стерильные чашки Петри слоем, толщиной 3-4 мм.Среда Клауберга II
К 100 мл 3% питательного агара рН 7,6, расплавленного и охлажденного до 50 ° С, добавляют 3 мл 2% раствора теллурита калия, 10 мл глицериновой смеси и 50 мл гемолизированной крови. Глицериновую смесь готовят путем добавления 20 мл стерильного глицерина до 40 мл дефибринированной крови. Смесь можно хранить в холодильнике в течение 4-х месяцев. Для приготовления гемолизированной ("лаковой") крови до 34 мл стерильной дистиллированной воды добавляют 16 мл дефибринированной крови.Транспортная полужидкая среда
К 100 мл перевар Хоттингера или мясопептонного бульона добавляют 1 г любого коммерческого агара, устанавливают рН 7,6, стерилизуют в автоклаве при 112 ° С 30 мин, асептически добавляют 10 мл сыворотки и 1 мл 2% теллурита калия. Среду разливают в пробирки по 5 мл. При возможности используют и более сложное транспортное среду Эмес (AMIES), модифицированное Стюартом.Посев от одного больного производят на одну чашку, используя при этом одну половину среды для посева из ротоглотки (миндалин, дужек, язычка), а вторую - для посева другим тампоном из носа. Если есть изучаемый материал из кожи, глаза, уши и других локализаций - добавляют еще одну чашку. Нельзя сеять материал от нескольких больных на одну чашку. Среды перед посевом согревают в термостате 15-20 мин.При посеве исследуемого материала втирают тампоном сначала в отдельный участок кровяного агара площадью 2x1 см, затем аналогично на кровяно-телуритовому агаре (или среде Клауберга II), при этом тампон все время поворачивают, чтобы засеять из него весь материал. Затем тем же тампоном штрихами засевают остальные поверхности среды (половину чашки). Такая техника посева позволяет получить изолированные колонии (чистую культуру), которые используют непосредственно из чашки для определения токсигенности и последующей их идентификации. Засеяны чашки или пробирки с транспортным средой инкубируют в термостате при 37 ° С в течение 20-24 час.На второй день с помощью стереоскопического микроскопа исследуют характер колоний. Если рост отсутствует на обеих средах, делают повторный забор материала.Чашки с типичными и подозрительными на C.diphtheriae колониями отбирают для дальнейшей идентификации культуры по всем тестам. Микроскопию подозрительных колоний можно не проводить.Колонии дифтерийных палочек на кровяном агаре беловатого или желтоватого цвета, непрозрачные, круглой, слегка выпуклой формы, диаметром 1-2 мм. Обычно они имеют маслянистую консистенцию, хотя некоторые могут образовывать хрупкие жесткие R-колонии.На кровяно-телуритових средах KonomiC.diphtheriae через 24 часа роста имеют серый цвет, выпуклые, с ровным краем, вязкие. Через 48 ч они приобретают темно-серого или черного цвета с металлическим блеском, равными или слегка фестончатыми краями, гладкой или с радиально исполосовано поверхностью (R-формы), вязкие или хрупкие при прикосновении петлей.По структуре 48-часовых колоний на телуритових средах и некоторыми ферментативными признаками возбудителя дифтерии выделяют четыре культурально-биохимических варианта (биовары) - gravis, mitis, belfanti, intermedius.Биовар gravis обычно образует серые или черные матовые сухие колонии, хрупкие, плоские, гладкие, диаметром 1,5-2 мм, с радиально исполосовано поверхностью, он высокотоксичный, не вызывает гемолиза, разлагает крахмал и гликоген.Биовары mitis и belfanti растут в виде серых или черных, круглых гладких выпуклых колоний с ровными краями, диаметром 1-1,5 мм эти варианты менее токсичны, вызывают гемолиз, но не разлагают крахмал и гликоген.Биовар intermedius образует мелкие, серые, прозрачные колонии диаметром 0,5-1 мм, с плоской гладкой поверхностью, он слаботоксичный, не расщепляет крахмала и гликогена.Если типичный рост отсутствует, из других, сомнительных колоний готовят мазки. При обнаружении в них споровых палочек, кокков, дрожжей и др.., Исследования на дифтерию прекращают и дают отрицательный ответ. Однако, важно помнить, что дифтерийные бактерии, которые образовали нетипичные колонии на средах с ингибиторами роста (теллурит калия), могут быть укорочены, утолщены, но сохраняют полиморфизм и характерное местоположение.При росте типичных колоний сразу же приступают к изучению их токсигенности и идентификации. Токсигенные свойства исследуют не менее в 2-х изолированных колоний путем посева одной половины каждой колонии на среду для определения токсигенности и непрожженные петлей на среду Пизу, а второй половины - на скошенный сывороточный агар для выделения чистой культуры и сохранения ее до окончания лабораторной диагностики. В случае, если на чашке вырастают одновременно токсигенные и нетоксигенные разновидности С. diphtheriae, необходимо при множественном росте подозрительных колоний исследовать токсигенные свойства около 20 колоний, засевая в одну бляшку материал из 5-6 колоний. При росте всего одной колонии, ее засевают на среду для определения токсигенности и, прокаливая петлю, - в пробирку со средой Пизу.Если использовали транспортную среду, висел из него делают в плотные кровяно-теллурита среды.На третий день, при появлении специфических линий преципитации в агаровом геле и положительной пробе на цистиназу, выделенную культуру определяют как токсигенные С. diphtheriae. Если линии преципитации через 24 часа отсутствуют, чашки инкубируют еще в течение суток. В случае отрицательной пробы Пизу культуру идентифицируют как вид коринебактерий.Чистую культуру на скошенном сывороточном агаре высевают на углеводородные среды с глюкозой, сахарозой, растворимым крахмалом, ставят пробы на выявление уреазы, пиразинамидазы и нитратредуктазы.На четвертый день делают учет результатов всех посевов и выдают аргументированный бактериологический вывод о выделенную культуру.Используют такие методы идентификации коринебактерий.Определение токсигенности in vitro
В его основе лежит взаимодействие токсина с антитоксином в агаровом геле. В местах оптимального количественного соотношения токсина и антитоксина в толще агара выпадает преципитат в виде тонких нежных белых линий ("стрелы", "усики"). Этот тест во многих странах за рубежом называют Элек-тестом.Пробу на токсигенность, как правило, проводят с чистыми культурами. Можно определить его и с культурами, загрязненными посторонней микрофлорой, в сутки ускоряет лабораторную диагностику дифтерии. Но при отрицательной пробе ее повторяют с выделенной чистой культурой.Для постановки этой пробы микробиологическая промышленность выпускает специальное сухое стандартное среду для определения токсигенности дифтерийных микробов (ВТДМ) и стандартные бумажные диски, пропитанные антитоксической противодифтерийной сывороткой и высушены.На поверхность свежеизготовленного среды ВТДМ накладывают бумажные диски с антитоксином (не более четырех на одну чашку). На расстоянии 0,5 см от диска вокруг него засевают культуры в виде "бляшек" диаметром 7-8 мм, чередуя "бляшки" изучаемой культуры и контрольного штаммаРезультаты учитывают через 18-24 и 48 год. Критерием специфичности преципитатов является слияние линий преципитации исследуемой культуры с линиями токсигенного штамма. В таком случае выделенную культуру считают токсигенных.При отсутствии стандартных бумажных дисков можно использовать полоски фильтровальной бумаги, пропитанные дифтерийными антитоксином. их изготавливают непосредственно в лаборатории. Нарезанные по указанным размерам и простерилизованные в автоклаве при 121 ° С в течение 30 мин бумажные полоски смачивают 0,25 мл очищенного дифтерийного антитоксина, который содержит 500 МЕ в 1 мл. В таком случае на чашку с соответствующим средой накладывают смоченную антитоксином полоску бумаги, подсушивают, открыв чашку на 15-20 мин в термостате и перевернув ее вверх дном. После этого с обеих сторон полоски засевают культуры "бляшками", чередуя исследуемые и контрольные штаммы.Для определения токсигенности возбудителя дифтерии можно использовать также и другие среды (АГВ, мартеновский агар и др.), рецепты изготовления которых приведены в "Инструкции по бактериологической диагностики дифтерии", Киев (1999).На протяжении многих лет токсигенность дифтерийных бактерий определяли подкожно или внутрикожно введением культуры двум гвинейским свинкам, одной из которых накануне вводят 100-1000 МЕ антитоксической противодифтерийной сыворотки. Теперь этот метод бактериологические лаборатории практически почти не используют из-за дороговизны и значительную задержку ответа.В последнее время разработаны очень чувствителен и высокоспецифичным метод определения гена дифтерийного токсина путем полимеризации цепной реакции. Он базируется на определении участка ДНК С. diphtheriae, где локализован ген дифтерийного токсина, с помощью специфических праймеров. Метод имеет преимущества перед традиционным определением токсигенности: высокую чувствительность, быстрота получения результатов (4-6 ч), не требует выделения чистой культуры. Но для его проведения необходимы специальная аппаратура, дорогие реактивы и соответствующее помещение, а потому может быть проведен лишь в специализированной лаборатории. Все нетоксигенные штаммы дифтерийных бактерий, выделенные от больных и бактерионосителей, необходимо направлять в Украинский центр госсанэпиднадзора (где есть такая лаборатория) для окончательного определения токсигенных свойств С. diphtheriae.Определение цистиназы (проба Пизу)
С. diphtheriae, С. ulcerans выделяют фермент цистиназу, псевдодифтерийни бактерии и другие дифтероиды его производят.Выделенную культуру засевают уколом в среду с цистином, разлитое столбиком в узкие пробирки. Цистиназопозитивни бактерии расщепляют цистин с выделением сероводорода, который с уксуснокислым свинцом, входящий в среде, образует сернокислый свинец, в результате чего среда окрашивается в темно-коричневый цвет. С. diphtheriae вызывает не только потемнение среды за ходом укалывания, а образует вокруг него "облако" темно-коричневого цвета на расстоянии 1 см от поверхности. Результаты учитывают через 20-24 ч инкубирования в термостате.Определение уреазы (проба Заксе)
Дифтерийные бактерии этого фермента не образуют. Положительную пробу на уреазу дают лишь некоторые другие виды коринебактерий. Для постановки пробы выделенную культуру сеют в бульон с мочевиной. Уреаза разлагает мочевину, изменяет рН среды, сопровождающееся его покраснением. Если фермент не выделяется, изменения окраски бульона не происходит.Определение пиразинамидазы
Определение пиразинамидазы проводят путем гидролиза пиразинамида в пиразиновой кислоты и аммония. Для этого в стерильную пробирку вливают 0,25 мл стерильной дистиллированной воды, в которой готовят густую взвесь выделенной культуры, затем вносят одну диагностическую таблетку Rosko 598-21. Инкубируют в течение 4-х часов при 37 ° С, после чего добавляют одну каплю только что приготовленного 5% водного раствора сульфата аммонийного железа. При наличии фермента суспензия приобретает красного или оранжевого цвета. Патогенные коринебактерии не выделяют пиразинамидазу, а следовательно, не изменяют цвета суспензии.Сахаролитические ферменты
Сахаролитические ферменты определяют путем посева полной петли выделенной культуры в каждую пробирку укороченного пестрого ряда Гисса (глюкоза, сахароза, растворимый крахмал). Результаты учитывают через 24 ч инкубации в термостате. Расщепление крахмала может задерживаться до 48 час.Определение нитратредуктазы
Определение нитратредуктазы является дополнительным тестом для идентификации С. belfanti и С. ulcerans, которые не образуют этого фермента. В пробирку с бульоном, в который добавляют 0,1% KN03, засевают исследуемую культуру, инкубируют в термостате в течение суток. Обязательном контроле со незасеянными средой. В случае наличия нитратредуктазы при добавлении к засеянного бульона 3-х капель реактива Касаткина возникает красное окрашивание. Среда в контрольной пробирке цвета не меняет.Для идентификации коринебактерий последнее время используют бумажные индикаторные диски с глюкозой, сахарозой, мочевиной и крахмалом из набора "Б" для идентификации энтеробактерий (фирма "ИмБио", г.Нижний Новгород). В 4-х пробирках готовят густую взвесь исследуемой культуры и в каждую из них погружают диск с соответствующим углеводом или иным реактивом. После инкубирования в термостате учет выделения уреазы проводят через 40-120 мин, а определение сахаролитических активности - через 5-24 часов. При наличии уреазы белый диск с мочевиной становится розово-малиновым, при отсутствии - остается белым. Диски с глюкозой и сахарозой при наличии соответствующих ферментов уже через 5-6 ч меняют цвет с красного на желтый. При определении амилазы в пробирку с соответствующим субстратом добавляют индикаторный диск с йодом. Если фермента нет - появляется темно-синюю окраску, если есть - цвет раствора остается без изменений.Специфическая профилактика и лечение
Вакцинопрофилактика дифтерии проводится при введении дифтерийного анатоксина, полученного при обработке дифтерийного токсина формалином. В нашей стране для вакцинации используют АКДС - адсорбированную коклюшно-дифтерийно-столбнячную вакцину. Антитоксическую сыворотку применяют для специфической терапии, а антибиотики - для санации бактерионосителей. Из антибиотиков используют пенициллин, ванкомицин, эритромицин и др.Инфекционисты в Москве
Инфекционисты в Москвеvse-zabolevaniya.ru
О заболеваемости дифтерией и состоянии антитоксического противодифтерийного иммунитета населения России, Письмо Роспотребнадзора от 09 декабря 2014 года №01/14530-14-27
О заболеваемости дифтерией и состоянии антитоксического противодифтерийного иммунитета населения России
В 2013 году в Российской Федерации сохранялась стабильная эпидемиологическая ситуация по дифтерии. В 4-х субъектах страны зарегистрированы 2 больных и 4 носителя токсигенных коринебактерий дифтерии.Среди заболевших один подросток (16 лет), проживающий в сельской местности, и один взрослый (54 года), привиты против дифтерии. С момента последней ревакцинации прошло от 2 до 8 лет. У обоих заболевших диагноз подтвержден бактериологически - дифтерия типа gravis. У подростка диагностирована субтоксическая форма дифтерии зева.Из 4 выявленных носителей - 3 дети, все привиты против дифтерии.За 10 месяцев 2014 года зарегистрирован 1 случай заболевания дифтерией токсической формы в Свердловской области, диагноз поставлен клинически без бактериологического подтверждения.Наличие токсических форм заболевания, отсутствие бактериологического подтверждения клинического диагноза "дифтерия" свидетельствуют о сохраняющихся недостатках в иммунопрофилактике и диагностике заболевания. Остается высоким число территорий, где не выявлены даже нетоксигенные коринебактерий дифтерии - от 20 до 30 субъектов за последние 3 года. Со снижением показателей выявляемых токсигенных коринебактерий дифтерии, снижаются показатели выявляемости нетоксигенных коринебактерий дифтерии (к 2013 году снизились в 2 раза). В то же время циркуляция токсигенных коринебактерий дифтерии на территории страны продолжается.Таким образом, несмотря на единичные случаи заболевания дифтерией, эпидемическая ситуация в отношении этой инфекции требует строгого контроля.Во исполнение решения коллегии Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека от 16.12.2011 "Актуальные вопросы эпиднадзора и профилактики дифтерии, столбняка, коклюша в условиях спорадической заболеваемости", в целях внедрения в практику ускоренных молекулярно-генетических методов диагностики дифтерии, специалистами ФБУН "Центральный НИИ эпидемиологии" Роспотребнадзора разработан набор реагентов для диагностики методом ПЦР.Ежегодно проводится анализ уровня иммунизации и состояния фактической защищенности против дифтерии населения страны.По состоянию на 01.01.2014 охват прививками детей до 14 лет составил - 98,5%, подростков 15-17 лет - 99,8%. Законченный курс вакцинации к 12 месяцам получили - 97,3% детей, законченный курс вакцинации и первую возрастную ревакцинацию к 24 месяцам - 97%.Охват прививками взрослых - 98,2%, в том числе в возрасте 60 и старше - 97,2%. Вместе с тем, в Калининградской области число привитых в возрасте 60 лет и старше составило 68,2% от числа контингента.В соответствии с методическими указаниями МУ 3.1.2943-11 "Организация и проведение серологического мониторинга состояния коллективного иммунитета к инфекциям, управляемым средствами специфической профилактики (дифтерия, столбняк, коклюш, корь, краснуха, эпидемический паротит, полиомиелит, гепатит В)" в 2013 году в субъектах Российской Федерации проводился серологический мониторинг состояния коллективного антитоксического иммунитета к дифтерии и столбняку.Однако в 32 субъектах серомониторинг проводился не в полном объеме: исключались отдельные возрастные группы или число обследованных в группе не соответствовало требуемой выборке (в Курганской области обследовано только 16 детей).В целях серомониторинга в стране было исследовано 60613 образцов сывороток, в том числе 10760 от детей, 11755 от подростков и 38098 от взрослых. В среднем по России данные серомониторинга подтвердили высокий охват прививками среди всех возрастных групп населения. Так, защитный уровень противодифтерийного антитоксического иммунитета выявлен у 95,8% детей 3-4 лет, 97,8% - подростков 15-17 лет и 93% - взрослых при высокой напряженности иммунитета 85,1%, 90,5% и 80,7% соответственно.Самая низкая защищенность от дифтерии среди детей 3-4 лет выявлена в 17 субъектах Российской Федерации: Калужская область - 83,3%, Костромская область - 90,5%, Тверская область - 78,5%, Республика Коми - 85,7%, Волгоградская область - 91,0%, Мурманская область - 86,1%, Новгородская область - 86%, Республика Ингушетия - 89,4%, Ставропольский край - 91%, Республика Мордовия - 90%, Удмуртская Республика - 91,7%, Пермский край - 89,2%, Челябинская область - 88,2%, Республика Алтай - 90,2%, Республика Бурятия - 88,7%, Республика Тыва - 85,4%, Новосибирская область - 91,3%, что не соответствует официальным сведениям об охвате прививками детей данного возраста на этих территориях. Первую ревакцинацию к возрасту 3-4 года в указанных субъектах имеют от 96,2% (Республика Ингушетия) до 99,4% (Республика Тыва) детей.Наименьшая защищенность у подростков зарегистрирована в Калужской и Тверской областях - 83,2% и 82%, Республике Ингушетия - 87,7%, при охвате прививками 99,8% ,99,8%, 96,4% соответственно.В разрезе возрастных групп взрослых защищенность и напряженность противодифтерийного иммунитета составили: среди лиц молодого возраста (18-39 лет) - 96% и 85,3%; 96,8% и 88,3%, в возрастной группе 40-49 лет - 92,8% и 81,4% соответственно. Наименьшие показатели отмечены в возрастной группе 50 лет и старше - 88% и 70,4%.Наиболее низкие показатели состояния антитоксического противодифтерийного иммунитета (ниже 90%) у взрослых выявлены в 15 субъектах Российской Федерации: Белгородской - 83,4%, Калужской - 79%, Тверской - 85,4%, Архангельской - 89,5%, Ленинградской - 79,2%, Новгородской - 81,6% областях, Краснодарском крае - 84,7%, Республике Ингушетия - 83,7%, Ставропольском крае - 84,7%, Республиках Мордовия - 84,2%, Чувашия - 82,5%, Челябинской области - 76,5%, Ханты-Мансийском автономном округе - 73%, Республике Бурятия - 88,2%, Красноярском крае - 88,6%. Полученные данные подтверждают необходимость проведения повторной ревакцинации против дифтерии взрослому населению, обратив особое внимание на лиц старшего возраста как группу риска по заболеваемости.Высокий уровень привитости детей, подростков и взрослых против дифтерии в среднем по России подтверждают результаты исследования антитоксического иммунитета к столбняку. В 2013 году защищенность против столбняка у этих контингентов составила 99,3%, 99,3%" и 97,9% при высокой напряженности иммунитета - 95,3%, 95,5%, 92% соответственно.Результаты серомониторинга в целом подтверждены и данными контрольных исследований 3361 сыворотки из 6 субъектов страны, проведенных в референс - центре по мониторингу за дифтерией.По результатам контрольных исследований образцов сывороток крови защищенность и напряженность противодифтерийного иммунитета в среднем у детей были высокими и соответствовали данным серомониторинга, проведенного в субъектах Российской Федерации: в 96,7% сывороток крови выявлены защитные титры дифтерийных антител, из них у 92,2% среднее и высокое содержание антитоксина. Наименьшая защищенность детей по результатам контрольных исследований отмечена в Пермском крае - 91,3% и совпадала с результатом серомониторинга - 89,2%, при этом уровень охвата прививками составил 99,6%.У подростков показатели защищенности и напряженности составили 98% и 96,5%, у взрослых - 94,7% и 85,7% соответственно.Наименьшая защищенность взрослых по результатам контрольных исследований выявлена в г.Москве 89,8 %, что ниже результатов серомониторинга, проводимого в этих субъектах - 98,1%.Таким образом, в 2013 году характер течения эпидемического процесса дифтерии в стране не претерпел изменений благодаря сохраняющейся высокой степени фактической защищенности населения всех возрастных групп.Учитывая вышеизложенное, принимая во внимание, что в 2014 году прошел 10-летний интервал с момента последней массовой иммунизации взрослого населения против дифтерии, в соответствии с Национальным календарем профилактических прививок взрослым необходимо провести очередную ревакцинацию лиц в возрасте 25 лет и старше, предлагаю:
1. Руководителям управлений Роспотребнадзора по субъектам Российской Федерации совместно с органами управления здравоохранением субъектов Российской Федерации представить в референс-центр по мониторингу за дифтерией сведения о планировании и отчет о проведении очередной ревакцинации взрослым против дифтерии и столбняка в 2014 году в соответствии с таблицей N 15 методических указаний МУ 3.1.3018-12 "Эпидемиологический надзор за дифтерией", дополнительно указав возрастные группы 18-24, 25-29 лет и т.д.
2. Руководителям управлений Роспотребнадзора по субъектам Российской Федерации, главным врачам ФБУЗ "Центр гигиены и эпидемиологии" Роспотребнадзора в субъектах Российской Федерации совместно с органами управления здравоохранением субъектов Российской Федерации:
2.1. Продолжить сбор культур коринебактерий дифтерии, коринебактерий других видов и штаммов с атипичными свойствами и направление их в референс-центр по мониторингу за дифтерией - ФБУН МНИИЭМ им.Г.Н.Габричевского Роспотребнадзора в соответствии с методическими указаниями Роспотребнадзора МУ 3.1.3018-12 "Эпидемиологический надзор за дифтерией" (приложение 1), МУК 4.2.3065-13 "Лабораторная диагностика дифтерийной инфекции (раздел 5) и письмом Роспотребнадзора от 19.06.2012 "Об организации исследований культур возбудителей дифтерии и коклюша".
2.2. В рамках взаимодействия с референс-центром по мониторингу за возбудителями инфекций верхних и нижних дыхательных путей (на базе ФБУН "Центральный НИИ эпидемиологии" Роспотребнадзора) направлять клинический материал от больных дифтерией, лиц с подозрением на дифтерию для проведения исследований по оценке диагностической значимости ускоренного молекулярно-генетического метода лабораторной диагностики дифтерии в соответствии с приложением.
3. Руководителям управлений Роспотребнадзора по Владимирской, Ивановской, Костромской. Кировской, Самарской, Сахалинской, Курганской, Липецкой, Рязанской, Тверской, Ярославской, Тамбовской, Тульской, Вологодской, Волгоградской, Ульяновской и Магаданской областям; по республикам Карачаево-Черкесской, Алтай, Мордовия, Саха (Якутия), Коми, Ингушетия, Хакасия, Тыва и Чеченской Республике; Ставропольскому, Камчатскому, Приморскому и Хабаровскому краям; Ханты-Мансийскому автономному округу и Еврейской автономной области совместно с органами управления здравоохранением субъектов Российской Федерации организовать проведение серомониторинга за состоянием антитоксического противодифтерийного иммунитета населения в полном объеме в соответствии с методическими указаниями МУ 3.1.3018-12 "Эпидемиологический надзор за дифтерией".
4. Руководителям управлений Роспотребнадзора по республикам Коми, Ингушетия, Мордовия, Алтай, Бурятия, Тыва и Удмуртской Республике, Волгоградской, Костромской, Мурманской, Новгородской, Челябинской, Новосибирской областям, Ставропольскому и Пермскому краям провести анализ причин недостаточной защищенности от дифтерии детей (по Калужской, Тверской областям и Республике Ингушетия - дополнительно и подростков), выявленной по результатам регионального серомониторинга. О результатах анализа и принятых мерах информировать Роспотребнадзор в срок до 01.03.2015.
5. Руководителям управлений Роспотребнадзора по Тверской (В.А.Синода), Волгоградской (А.В.Злепко), Челябинской (А.И.Семенов) областям совместно с органами управления здравоохранением субъектов Российской Федерации организовать сбор и доставку по 100 сывороток крови детей 3-4 лет с данными о прививках против дифтерии и столбняка в ФБУН МНИИЭМ им Т.Н.Габричевского Роспотребнадзора в срок до 01.04.2015.
6. Руководителям управлений Роспотребнадзора по Республике Мордовия (Т.П.Харитонова) и Челябинской (А.И.Семенов) области совместно с органами управления здравоохранением субъектов Российской Федерации организовать сбор и доставку 500 сывороток крови взрослых без учета прививок (по 100 сывороток в каждой возрастной группе: 20-29, 30-39, 40-49, 50-59, 60 лет и старше) в референс-центр по мониторингу за дифтерией - ФБУН МНИИЭМ им Г.Н.Габричевского Роспотребнадзора в срок до 01.04.2015.
РуководительА.Ю.Попова
Приложение. Условия сбора, хранения, направления и транспортирования клинического материала, поступающего в ФБУЗ "Центр гигиены и эпидемиологии в субъектах Российской Федерации" Роспотребнадзора с диагностической целью от больных с подозрением ...
Приложение к письму Роспотребнадзораот 9 декабря 2014 года N 01/14530-14-27
С целью оценки диагностической значимости нового ускоренного метода ПЦР-диагностики дифтерии, в ФБУН "Центральный НИИ эпидемиологии" Роспотребнадзора следует направлять клинический материал (после проведения бактериологического посева), из которого были выделены культуры коринебактерий, в том числе Corynebacterium diphtheriae, C.ulcerans, коринебактерий других видов и без видовой идентификации, а также клинический материал, в котором коринебактерий обнаружены не были.После проведения бактериологического посева, тампон следует поместить в пластиковую пробирку объемом 1,5-2 мл (типа Эппендорф или аналогичную) с транспортной средой в количестве 1 мл (среда готовится согласно МУК 4.2.3065-13 "Лабораторная диагностика дифтерийной инфекции"), соблюдая условия стерильности отрезать длинную часть тампона (используя отдельные для каждого образца автоклавированные ножницы), герметично закрыть пробирку и заморозить (при температуре от минус 20 °С до минус 70 °С).В том случае, если в лабораторию поступил тампон с клиническим материалом в транспортной среде, после проведения посева, остатки транспортной среды, в которой находился тампон, следует отобрать в количестве 1 мл с помощью одноразовой пластиковой стерильной пипетки (на 1 мл) в пробирку объемом 1,5-2 мл (типа Эппердорф или аналогичную), добавить тампон, которым проводили посев, соблюдая условия стерильности отрезать длинную его часть (используя отдельные для каждого образца автоклавированные ножницы), герметично закрыть пробирку и заморозить (от минус 20 °С до минус 70 °С).При выделении культуры коринебактерий с помощью бактериологического исследования, необходимо предоставить описание культуры (номер культуры, вид коринебактерий, наличие токсина, результаты тестов по определению биохимических свойств) и указать методы, использованные с целью определения вида и токсигенности.В тех случаях, когда культура коринебактерий не была выделена, сохранять не более 50 образцов клинического материала, подготовленного описанным выше способом.К образцам клинического материала необходимо приложить сопроводительную информацию о пациентах (возраст, пол, диагноз при направлении, регистрационный номер образца, номер соответствующей культуры, если культуры выделены из одного очага инфекции, то указать эту информацию в примечании).Транспортировку осуществлять в соответствии с установленными требованиями методических документов по транспортировке патогенного материала возбудителей III-IV группы патогенности (Санитарно-эпидемиологические правила СП 1.2.036-95 "Порядок учета, хранения, передачи и транспортирования микроорганизмов I-IV групп патогенности").О наличии образцов информировать руководителя Референс-центра по мониторингу за возбудителями инфекций верхних и нижних дыхательных путей Роспотребнадзора (ФБУН "Центральный НИИ эпидемиологии" Роспотребнадзора, Яцышина С.Б., тел.89268008003), который обеспечит доставку образцов в ФБУН "Центральный НИИ эпидемиологии" Роспотребнадзора по мере их накопления (по согласованию) или однократно до 01.04.2015 года.Электронный текст документаподготовлен ЗАО "Кодекс" и сверен по:рассылка
docs.cntd.ru
 |  |  |  |  |  |  |  |  |  |  |  |  |  |  |
 Пример видео 3 Пример видео 3 |  Пример видео 2 Пример видео 2 |  Пример видео 6 Пример видео 6 |  Пример видео 1 Пример видео 1 |  Пример видео 5 Пример видео 5 |  Пример видео 4 Пример видео 4 |
Администрация муниципального образования «Городское поселение – г.Осташков»























