Методы определения чувствительности микроорганизмов к антибиотикам. Мук определение чувствительности к антибиотикам 2014
Клинические рекомендации | Раздел Главного внештатного специалиста Минздрава России по клинической микробиологии и антимикробной резистентности
- Определение чувствительности микроорганизмов к антимикробным препаратам (2018)
Новая версия 2018-03
Скачать ![]() PDF, 5,0 Мб
PDF, 5,0 Мб
- Определение чувствительности микроорганизмов к антимикробным препаратам (2015)
Версия, зарегистрированная в Федеральной медицинской библиотеке в 2016 году
Скачать ![]()
Подробнее…
Рекомендации утверждены:
- Расширенное совещание Межрегиональной ассоциацией по клинической микробиологии и антимикробной химиотерапии (Москва, 22.05.2014 г.)
Рекомендации подготовлены:
- Научно-исследовательским институтом антимикробной химиотерапии ГБОУ ВПО «Смоленский государственный медицинский университет» Министерства Здравоохранения РФ, г. Смоленск (Козлов Р.С., Сухорукова М.В., Эйдельштейн М.В., Иванчик Н.В., Склеенова Е.Ю., Тимохова А.В., Дехнич А.В.)
- ФГБУ «НИИ детских инфекций федерального медико-биологического агентства России», г. Санкт-Петербург (Сидоренко С.В., Партина И.В., Гостев В.В., Агеевец В.А.)
- ФБУН НИИ эпидемиологии и микробиологии имени Пастера, г. Санкт-Петербург (Кафтырева Л.А., Егорова С.А., Макарова М.А.)
- Научно-исследовательский институт медицинской микологии им. П.Н. Кашкина ГБОУ ВПО «Северо-Западный государственный медицинский университет» Министерства Здравоохранения РФ, г. Санкт-Петербург (Васильева Н.В., Климко Н.Н., Богомолова Т.С., Рауш Е.Р., Выборнова И.В.)
- ФГБУ «Федеральный научно-исследовательский центр эпидемиологии и микробиологии имени почётного академика Н.Ф. Гамалеи» Министерства Здравоохранения РФ, г. Москва (Тартаковский И.С.)
Клинические рекомендации обсуждены и одобрены на экспертном совещании профильной комиссии по специальности «Клиническая микробиология и антимикробная резистентность» (г. Саратов, 17.10.2015 г.)
- Определение чувствительности микроорганизмов к антимикробным препаратам (2014)
Зарегистрировано в Федеральной медицинской библиотеке в 2014 году
Скачать ![]() PDF, 4,70 Мб
PDF, 4,70 Мб
Подробнее…
Рекомендации утверждены:
- Расширенное совещание Межрегиональной ассоциацией по клинической микробиологии и антимикробной химиотерапии (Москва, 23.05.2014 г.)
- Совещание рабочей группы по медицинской микробиологии профильной комиссии МЗ РФ по КЛД (г. Санкт-Петербург, 10.05.2014 г.)
Рекомендации подготовлены:
- Научно-исследовательским институтом антимикробной химиотерапии ГБОУ ВПО «Смоленская государственная медицинская академия» Министерства Здравоохранения РФ, Смоленск (Козлов Р.С., Сухорукова М.В., Эйдельштейн М.В., Иванчик Н.В., Склеенова Е.Ю., Тимохова А.В., Дехнич А.В.)
- ФГБУ «НИИ детских инфекций федерального медико-биологического агентства России», Санкт-Петербург (Сидоренко С.В., Партина И.В., Гостев В.В., Агеевец В.А.)
- ФБУН НИИ эпидемиологии и микробиологии имени Пастера, Санкт-Петербург (Кафтырева Л.А., Егорова С.А., Макарова М.А.)
- Научно-исследовательский институт медицинской микологии им. П.Н. Кашкина ГБОУ ВПО «Северо-Западный государственный медицинский университет» Министерства Здравоохранения РФ, Санкт-Петербург (Васильева Н.В., Климко Н.Н., Богомолова Т.С., Рауш Е.Р., Выборнова И.В.)
- ФГБУ «НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи» Министерства Здравоохранения РФ, Москва (Тартаковский И.С.)
- Клинические рекомендации по выделению, идентификации и определению чувствительности Helicobacter pylori к антимикробным препаратам
Скачать ![]()
Подробнее…
Настоящие клинические рекомендации определяют алгоритмы микробиологической диагностики геликобактерной инфекции и определения чувствительности Helicobacter pylori к антимикробным препаратам. Версия: октябрь 2017
www.antibiotic.ru
Методы определения чувствительности микроорганизмов к антибиотикам
Диско-диффузионный метод
На поверхность плотной питательной среды, засеянной сплошным газоном исследуемой культурой, накладывают не более 6 дисков, пропитанных антибиотиками, на расстоянии не менее 2 см друг от друга. Регистрация результатов проводится через 18-24 часов инкубирования в термостате по диаметру зоны отсутствия роста вокруг дисков с антибиотиками. Наличие роста вокруг диска свидетельствует о нечувствительности данного микроба к антибиотику. Для интерпретации результатов используются специальные таблицы.
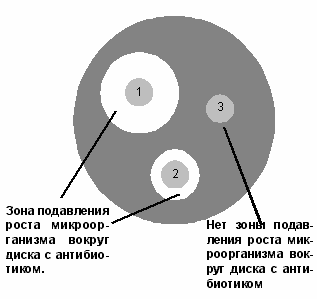
Рисунок 1. Определение чувствительности
микроорганизмов диско-диффузионным методом:
1 – микроорганизм чувствителен к антибиотику;
2 – микроорганизм умеренно резистентен к антибиотику;
3 – микроорганизм устойчив к антибиотику.
Метод Е-тестов
Принцип метода. Определение чувствительности микроорганизма проводится аналогично тестированию диско-диффузионным методом. Отличие состоит в том, что вместо диска с антибиотиком используют полоску Е-теста, содержащую градиент концентраций антибиотика от максимальной к минимальной. В месте пересечения эллипсовидной зоны подавления роста с полоской Е-теста получают значение минимальной подавляющей концентрации (МПК).
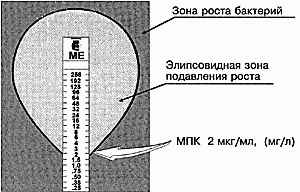
Рисунок 2. Определение чувствительности микроорганизмов с помощью Е-тестов
В пробирках, содержащих 1 мл Мюллер-Хинтон бульона, готовят серийные двукратные разведения антибактериального препарата, например 100 мкг/мл – 1-я, 50 мкг/мл – 2-я, 25 мкг/мл – 3-я, 12,5 мкг/мл – 4-я и т.д. Затем в каждую пробирку вносят 0,1 мл испытуемой бактериальной суспензии. Одновременно ставят контроль роста (1 мл Мюллер-Хинтон бульона и 0,1 мл суспензии бактерий). Посевы инкубируют при 37°С в течение 18-24 ч., после чего отмечают результаты. Отсутствие помутнения среды свидетельствует о задержке роста бактерий в присутствии данной концентрации препарата.

Рисунок 3. Определение значения МПК методом разведения в жидкой питательной среде
Минимальная подавляющая концентрация (МПК) – наименьшая концентрация антибиотика (в мкг/мл или мг/л), которая in vitro полностью подавляет видимый рост бактерий.
2► Определение чувствительности разных штаммов стафилококков к антибиотикам методом стандартных дисков
| Антибиотик | Зона подавления роста, мм | Характеристика штамма |
| 1. | ||
| 2. | ||
| 3. | ||
| 4. | ||
| 5. | ||
| 6. |
Исследуемая культура является чувствительной к __________________________________________________
умеренно устойчивой к _________________________________________________________________________,
устойчивой к _________________________________________________________________________________.
Достоинства метода:____________________________________________________________________________
3►Определение минимальной подавляющей концентрации (МПК) пенициллина методом серийных разведений.
Вывод: МПК пенициллина для исследуемого штамма составляет _____________________________________
Достоинства метода:____________________________________________________________________________
Недостатки метода:____________________________________________________________________________
4►Выявление и регистрация антагонистического действия разных видов бактерий.
На чашку с МПА штрихом по диаметру засевается микроб-антагонист и перпендикулярно к нему тест-штаммы. Учет результатов проводится через сутки после посева. Наличие и степень антагонистического действия определяют по величине зон задержки роста тест-культур.

Штриховой посев________________________
Вывод: наибольшее антагонистическое действие выявлено к тест-штаммам (укажите виды) _____________________________________________________________________________________________
ЗАНЯТИЕ № 8
ТЕМА: ИТОГОВОЕ ЗАНЯТИЕ ПО ТЕМЕ: «ИСТОРИЧЕСКИЕ ЭТАПЫ РАЗВИТИЯ МИКРОБИОЛОГИИ, МОРФОЛОГИЯ, ФИЗИОЛОГИЯ И ГЕНЕТИКА МИКРООРГАНИЗМОВ».
ПЕРЕЧЕНЬ КОНТРОЛЬНЫХ ВОПРОСОВ
Формы и размеры истинных бактерий. Характеристика шарообразных, палочковидных и извитых форм истинных бактерий.
Структура бактерий. Основные отличия прокариотной клетки от эукариот.
Клеточная стенка грамположительных и грамотрицательных бактерий.
Типы микроскопических препаратов. Техника приготовления фиксированных препаратов.
Техника микроскопии в световом микроскопе. Изучение морфологии микроорганизмов в электронном микроскопе.
Тинкториальные свойства микробов. Красители. Простые способы окраски фиксированных препаратов.
Принципы классификации патогенных прокариот (Берджи, 2001).
Защитные приспособления у микроорганизмов. Споры, стадии и условия образования спор, биологическое значение.
Капсулы бактерий, их значение.
Жгутики, их строение. Реснички. Секс-пили.
Сложные способы окраски. Техника окраски по Граму, Цилю-Нельсену, Бурри-Гинсу, Нейссеру.
Методы исследования микроорганизмов в живом состоянии. КОН-тест. Принцип метода.
Спирохеты. Систематическое положение и морфология спирохет. Особенности ультраструктуры и химического состава. Методы исследования.
Актиномицеты, морфология, ультраструктура, химический состав. Патогенные виды. Роль актиномицетов в природе и медицине. Методы выявления.
Таксономия хламидий. Морфология, структура, способы выявления. Цикл развития хламидий.
Риккетсии, морфология, ультраструктура, химический состав. Патогенные виды.
Микоплазмы. Классификация. Филогенез. Способы выявления.
Питание бактерий. Питательные вещества – источники углерода и азота. Классификация бактерий по типам питания Аутотрофы и хемоорганотрофы
Факторы роста и их источники. Источники минеральных элементов.
Способы и механизмы переноса питательных веществ через мембрану.
Энергетические потребности бактерий. Пути получения энергии у аутотрофов (фотосинтез, хемосинтез). Источники и пути получения энергии у хемоорганотрофов.
Аэробный и анаэробный типы биологического окисления у бактерий. Аэробные, анаэробные, факультативно анаэробные и микроаэрофильные бактерии. Способы создания анаэробных условий.
Задачи, этапы, преимущества и недостатки бактериологического (культурального) метода исследования.
Рост и размножение микроорганизмов. Способы размножения. Бинарное (простое) деление, механизм. Размножение бактериальных популяций.
Принципы и методы культивирования бактерий. Питательные потребности микробов.
Питательные среды для культивирования бактерий. Требования к питательным средам. Классификация питательных сред.
Условия и техника культивирования бактерий. Техника посева на питательные среды. Закономерности и характер роста бактерий на плотных и жидких питательных средах.
Способы выделения чистых культур аэробных и анаэробных бактерий.
Свойства микроорганизмов, используемые для идентификации выделенных культур.
Ферменты бактерий, классификация. Способы изучения биохимических свойств микроорганизмов. Практическое использование биохимической активности в идентификации бактерий
Определение сахаролитических свойств, состав сред Гисса; определение протеолитических свойств, определение каталазной и оксидазной активности.
Принцип работы и особенности применения приборов автоматической идентификации бактериальных культур (гемокультиватор, автоматический анализатор).
Особенности культивирования риккетсий и хламидий.
Бактериофаги (фаги). История открытия. Морфология, структурные особенности, химический состав и свойства фагов.
Вирулентные фаги. Фазы взаимодействия с бактериальной клеткой. Результаты взаимодействия фага и клетки. Умеренные фаги. Профаг. Явление лизогении. Фаговая конверсия.
Методы выделения и титрования бактериофагов на плотных и жидких питательных средах.Применение фагов в микробиологии и медицине. Фагодиагностика и фаготипирование.
Наследственность. Организация генетического аппарата у бактерий (нуклеоид, плазмиды, Is-последовательности, транспозоны).
Принципы функционирования бактериального генома. Организация оперона. Генотип и фенотип.
Плазмиды, классификация, структура и свойства плазмид. R-плазмида, особенности структуры и функции. Плазмиды бактериоциногении.
Изменчивость микробов. Модификации у бактерий, значение, основные проявления и свойства (ненаследственный характер, адаптивность, высокая частота прямых и обратных изменений, множество индуцирующих факторов).
Генотипическая изменчивость. Мутации и их классификация. Мутагены. Фенотипические проявления мутаций. Судьба мутантов. Диссоциация у бактерий. Влияние отбора. Система репарации повреждений генома.
Рекомбинационная изменчивость. Механизмы образования комбинированных геномов. Частота изменений отдельных признаков. Трансформация, трансдукция, конъюгация.
Практическое значение знаний о генетике микробов. Принципы генетического картирования.
Методы генетического анализа (молекулярная гибридизация, полимеразная цепная реакция, блотинг, секвенирование).
Понятие о генной инженерии и использование ее методов в микробиологии и биотехнологии. Получение и применение генно-инженерных вакцин и цитокинов.
Противомикробные мероприятия. Влияние экологических факторов на микробы. Действие физических факторов (температуры, высушивания, излучений, ультразвука, осмотического давления). Действие химических факторов.
Цели, способы, средства и объекты стерилизации и дезинфекции в медицинской и микробиологической практике. Контроль качества дезинфекции. Контроль стерилизации и стерильности. Способы проведения.
Антисептика. Определение. Антисептические средства, требования, происхождение, свойства, группы, механизмы действия на микробы. Типы антисептики. Терапевтическая антисептика. Профилактическая антисептика.
Химиотерапевтические препараты. Свойства. Основные группы химиопрепаратов. Механизмы действия на бактерии. Понятие об избирательности и "мишенях" действия.
Органические и неорганические соединения металлов и металлоидов. Сульфаниламидные препараты. Препараты нитрофуранового ряда. Противогрибковые, противовирусные, противопаразитарные химиопрепараты.
Антибиотики. Определение. Продуценты антибиотиков. Синтетические и полусинтетические антибиотики.
Основные группы антибиотиков по химической структуре. Бета-лактамные антибиотики Тетрациклины. Аминогликозиды. Макролиды и азолиды. Анзамицины (рифампицины). Левомицетин. Фторхинолоновые антибиотики. Линкомицин. Полимиксины. Гликопептиды
Классификация антибиотиков про механизму действия на бактериальную клетку.
Механизмы устойчивости микроорганизмов к антибактериальным препаратам.
Методы определения чувствительности бактерий к антибиотикам и другим химиопрепаратам. Техника постановки, учета и оценки чувствительности методом дисков, Е-теста, серийных разведений.
ЗАНЯТИЕ № 9
ТЕМА: ЭКОЛОГИЯ БАКТЕРИЙ. ИНФЕКЦИЯ. ПАТОГЕННЫЕ МИКРООРГАНИЗМЫ. ТОКСИНЫ МИКРОБОВ. БИОЛОГИЧЕСКИЙ (ЭКСПЕРИМЕНТАЛЬНЫЙ) МЕТОД.
ПЕРЕЧЕНЬ КОНТРОЛЬНЫХ ВОПРОСОВ
Основные понятия экологической микробиологии (популяция, биотоп, микробиоценоз, экосистема, биосфера). Экологические связи микробов (симбиоз, комменсализм, нейтрализм, конкуренция, паразитизм, хищничество).
Микрофлора тела человека. Нормальная (резидентная) микрофлора человека. Аутохтонная и аллохтонная, пристеночная и просветная микрофлора. Формирование и развитие нормальной микрофлоры. Функции нормальной микрофлоры: противоинфекционная, метаболическая, иммунобиологическая, антитоксическая.
Дисмикробиоценоз (дисбактериоз), причины, виды, принципы коррекции.
Понятие об инфекции. Определение, общая характеристика. Отличия инфекционных болезней от неинфекционных.
Роль микроорганизма в инфекционном процессе. Инфицирующая доза. Способы заражения. Входные ворота. Патогенность и вирулентность. Генетический контроль патогенности и вирулентности. Факторы, повышающие и снижающие вирулентность микробов.
Факторы патогенности. Методы определения вирулентности, единицы. Облигатно-патогенные и условно-патогенные микроорганизмы.
Токсичность и токсигенность микроорганизмов. Эндотоксины, свойства, получение, применение. Экзотоксины, свойства, получение, единицы измерения. Типы экзотоксинов, механизм действия.
Роль макроорганизма в развитии и течении инфекционных болезней. Наследственные факторы. Анатомо-физиологическое состояние организма. Роль условий жизни в развитии и течении инфекционных болезней. Природные факторы. Социальные факторы.
Классификация инфекционных процессов по тяжести, характеру возбудителя, по источнику инфекции, способу передачи возбудителя и механизму заражения, по распространенности. Классификация инфекционных процессов по локализации микробного очага, длительности течения и кратности заражения.
Динамика инфекционного процесса, его особенности.
Биологический (экспериментальный) метод исследования, этапы, оценка. Лабораторные животные. Способы заражения.
ЛАБОРАТОРНАЯ РАБОТА
1► Изучения нормальной микрофлоры.
А) Посев для изучения нормальной микрофлоры кожи рук на среду Эндо и кровяной агар методом реплик.
Принцип метода: стерильные кусочки фильтровальной бумаги 1х1 см в чашке Петри увлажнить стерильным физ. раствором. Стерильным пинцетом поместить кусочек бумаги на исследуемую поверхность кожи рук на 0,5 мин. Поместить бумагу на поверхность плотной питательной среды (отпечаток) на 1 мин. Бумагу удалить. Чашки с отпечатками инкубировать при 370С, 24-48 часов.
В) Провести учет посева микрофлоры, приготовить препараты из разных типов колоний, окрасить по Граму, микроскопировать (в демонстрационных посевах).
Учет посева микрофлоры:
| биотоп | |
| количество и характер колоний на кровяном агаре | |
| количество и характер колоний на среде Эндо |
Микроскопия препаратов:
| Препарат ______________ _______________________ Окраска _______________ _______________________ | | Препарат ______________ _______________________ Окраска _______________ _______________________ | |
2► Оценка адгезивности E.coli по их способности к адсорбции на поверхности эритроцитов
Принцип метода: К суспензии эритроцитов добавляют испытуемую культуру микроорганизмов. После инкубации готовят мазки, окрашивают и под микроскопом определяют среднее количество бактерий, адсорбировавшихся на одном эритроците.
Эритроциты в данном случае используются в качестве модели клетки восприимчивого микроорганизма.
| | Окраска по ______________ Увеличение _____________ 1 - эритроцит 2 - E.coli |
3► Определение ферментов инвазивности у стафилококков
1. Плазмокоагулаза
Принцип метода: В пробирку, содержащую цитратную плазму крови кролика, вносится испытуемая культура. После инкубации в термостате учитывается результат. При положительном результате плазма свертывается (коагулирует).
| S. aureus | Штамм № 1 | Штамм № 2 |
| Результат |
2. Фибринолизин
Принцип метода: В пробирку с фибрином (отмытый от эритроцитов сгусток крови) вносят испытуемую культуру. После инкубации в термостате учитывается результат. При положительном результате сгусток растворяется.
| S. aureus | Штамм № 1 | Штамм № 2 |
| Результат |
3. Гиалуронидаза
Принцип метода: В пробирку с гиалуроновой кислотой (ГУК) вносят испытуемую культуру. После инкубации в термостате добавляют реактив, вызывающий свертывание ГУК и учитывают результат. При положительном результате (вследствие расщепления ГУК) сгустка не образуется.
| S. aureus | Штамм № 1 | Штамм № 2 |
| Результат |
4. Лецитовителлаза (лецитиназа)
Принцип метода: выделенные культуры стафилококка засевают на желточно-солевой агар, который содержит 7,5% хлорида натрия и желточную суспензию. При положительном результате вокруг колоний вирулентных стафилококков образуется радужный ореол вследствие расщепления лецитина, содержащегося в желтке куриного яйца.
| S. aureus | Штамм № 1 | Штамм № 2 |
| Результат |
Вывод: (перечислите ферменты вирулентности каждого из двух изученных штаммов) _____________________________________________________________________________________________
_____________________________________________________________________________________________
Бактериальные токсины
Токсичность __________________________________________________________________________________
Токсигенность _________________________________________________________________________________
Эндотоксин ___________________________________________________________________________________
Эндотоксический шок ___________________________________________________________________________
Практическое применение эндотоксинов:
1.____________________________________________________________________________________________
2.____________________________________________________________________________________________
Экзотоксин ___________________________________________________________________________________
Анатоксин ____________________________________________________________________________________
Схема получения экзотоксина и анатоксина.
1.____________________________________________________________________________________________
2.____________________________________________________________________________________________
3.____________________________________________________________________________________________
4.____________________________________________________________________________________________
Практическое применение анатоксинов:
1.____________________________________________________________________________________________
2.____________________________________________________________________________________________
3.____________________________________________________________________________________________
studfiles.net
Методические указания по применению унифицированных методов определения чувствительности микроорганизмов к химиотерапевтическим препаратам, Приказ Минздрава СССР от 13 марта 1975 года №250
Приложение N 2к приказу Минздрава СССРот 13 марта 1975 г. N 250
1. Микробиологические исследования
1.1. Определение чувствительности микроорганизмов к химиотерапевтическим препаратам
Критерии чувствительности микроорганизмов к химиотерапевтическим препаратам
Успех химиотерапии во многом зависит от правильного выбора соответствующего лечебного препарата, для чего крайне важно располагать сведениями о чувствительности возбудителя болезни к избираемому для лечения препарату.В клинической практике чувствительными к препарату считаются те микроорганизмы, на которые препарат в концентрации, достигаемой в очаге инфекции, оказывает бактериостатическое или бактерицидное действие. В соответствии с этим критерии чувствительности микроорганизмов зависят от концентрации лечебного препарата в очаге инфекции, величины максимальной терапевтической дозы препарата, его фармакокинетики и токсичности.Мерой чувствительности микроорганизмов к химиотерапевтическим препаратам при постановке лабораторного теста является минимальная концентрация препарата, ингибирующая рост возбудителя заболевания при стандартных условиях постановки опыта. Деление микроорганизмов на устойчивые и чувствительные производится на основании соотношения минимальной ингибирующей рост микроба концентрации препарата, определенной в лабораторных условиях, концентрации этого же препарата, создаваемой в очаге инфекции при введении терапевтических доз. При соотношении
можно говорить о чувствительности микроорганизма к данному химиотерапевтическому препарату.Для клинической практики целесообразно делить микроорганизмы по степени чувствительности к химиотерапевтическим препаратам условно на 4 группы:1-я группа - "чувствительных" микроорганизмов, когда обычно применяемые дозы препарата являются достаточными для достижения лечебного эффекта при общих заболеваниях;2-я группа - "средне чувствительных" микроорганизмов, когда только повышенные дозы препарата могут обеспечить лечебный эффект при общих заболеваниях;3-я группа - "умеренно устойчивых" микроорганизмов, когда лечебный эффект может быть достигнут только при локализации инфекционного очага в месте, где препарат концентрируется, или если препарат может быть введен непосредственно в очаг инфекции;4-я группа - "устойчивых" микроорганизмов, когда нельзя рассчитывать на лечебный эффект.Особенно важно определять чувствительность возбудителя заболевания к химиотерапевтическим препаратам:- при процессах, вызванных микроорганизмами часто устойчивыми к лечебным препаратам;- при затяжных инфекциях, когда сопротивляемость макроорганизма нарушена и выбор наиболее активного препарата играет особо важную роль;- при применении препаратов, к которым во время лечения быстро развивается устойчивость (стрептомицин, рифампицин и некоторые другие.В настоящее время предложены критерии чувствительности микроорганизмов только для некоторых антибиотиков (табл.1). Для других химиотерапевтических препаратов критерии чувствительности разрабатываются.
Таблица 1
Классификация микроорганизмов по степени чувствительности к антибиотикам (МИК в мкг/мл или ед/мл)
| Антибиотики | Группы микроорганизмов | |||
| I | II | III | IV | |
| чувствит. | средн. чувст. | умер. устойч. | устойч. | |
| Пенициллин G | 0,25 | 16 | 128 | 128 |
| Пенициллин V | 0,25 | 4 | 128 | 128 |
| Метициллин+) | 2 | х | х | х |
| Ампициллин+) | 0,25 | 16 | 128 | 128 |
| Карбенициллин | х | 16 | 128 | 128 |
| Цефалоспорины | 2 | 16 | 128 | 128 |
| Стрептомицин+) | 4 | х | 128 | 128 |
| Канамицин+) | 4 | х | 128 | 128 |
| Неомицин+) | 4 | х | 128 | 128 |
| Гентамицин | 0,5 | 4 | 64 | 64 |
| Левомицетин+) | 1 | 8 | х | х |
| Препараты тетрациклинового ряда | 1 | 4 | 64 | 64 |
| Эритромицин | 1 | 4 | 64 | 64 |
| Линкомицин+) | 1 | 4 | 64 | 64 |
Примечания: +) - критерии чувствительности относятся ко всем лекарственным формам указанного антибиотика.х - группа не установлена.
Взятие материала для выделения возбудителя заболевания и определения его чувствительности к лекарственным препаратам
Важным условием соответствия результатов определения чувствительности микроорганизмов к химиотерапевтическим препаратам и клинической эффективности последних является исследование чувствительности чистых культур истинных возбудителей инфекции, а не сопутствующей им микрофлоры. Поэтому при взятии материала для исследования следует соблюдать следующие правила:
1. Материал должен быть получен до начала антибактериальной терапии или через такой период после введения антибактериального препарата, который необходим для его элиминации из организма больного.
2. Материал для посева при определении чувствительности следует брать непосредственно из очага инфекции с соблюдением правил асептики (стерильными инструментами, в стерильную посуду и т.п.).
3. В тех случаях, когда взятие материала непосредственно из очага инфекции невозможно, но он сообщается с внешней средой, можно производить исследование соответствующего отделяемого: мочи при пиелонефрите, мокроты при воспалительных процессах в легких, отделяемого цервикального канала при сальпингоофоритах и т.д. Перед сбором материала для посева следует провести предварительную обработку антисептическими растворами доступных для этого полостей или поверхностей человеческого организма, по которым проходит исследуемый материал.Например, при сборе мокроты больной должен утром до еды почистить зубы, прополоскать рот слабым раствором антисептика и затем откашлять мокроту в стерильную карманную плевательницу или прокипяченную баночку с крышкой. При этом больному надо объяснить, что он не должен собирать носоглоточную слизь и слюну, а должен стараться собрать только отделяемое дыхательных путей. Если мокрота отделяется плохо, больному следует накануне назначить отхаркивающее.Мочу для посева после тщательного туалета наружных половых органов 0,5% раствором марганцевокислого калия берут стерильно катетером или получают ее при естественном мочеиспускании, отбросив первую небольшую порцию ("первую струю").
4. Посев материала, взятого у больного, производят на соответствующий набор питательных сред, необходимых для выделения чистых культур различных видов микроорганизмов. В смешанной культуре производить определение чувствительности к антибактериальным препаратам не следует, так как скорость роста различных микроорганизмов, присутствующих в ассоциациях, неодинакова и при подобном методе исследования определяется чувствительность к антибактериальным препаратам наиболее быстро растущих видов, не всегда являющихся возбудителями заболеваний. Кроме того, при определении чувствительности бактерий в смешанных культурах можно получить ложные результаты за счет микробного антагонизма, когда рост одной культуры может быть подавлен не антибактериальным действием препарата, а вследствие антагонистического влияния другой культуры.
5. Если в исследуемом материале находится несколько видов условнопатогенных микроорганизмов, необходимо выяснить, какой из них является ведущим в данном патологическом процессе.
Ориентировочные данные можно получить при использовании метода количественного учета обсемененности материала, например, определение степени бактериурии при пиелонефритах - преобладание в моче одного вида микроорганизмов может свидетельствовать о его этиологической роли в данном процессе.С этой же целью проводится бактериоскопическое исследование материала, нацеливающее бактериолога на определенную флору, которую он должен будет получать, применяя селективные и элективные среды. Например, в мокроте больного пневмонией при бактериоскопии обнаружены в большом количестве пневмококки и в значительно меньшем - стрептококки и стафилококки. При первичном посеве мокроты пневмококки могут не вырасти совсем или вырасти в относительно небольшом количестве. Однако, бактериолог, ориентированный по мазку из посевного материала, приложит усилия для выделения и определения чувствительности к антибактериальным препаратам именно пневмококков.
6. Если выяснение истинного возбудителя не удается, или патологический процесс вызван микробной ассоциацией, исследуется раздельно чувствительность к антибактериальным препаратам всех членов, выделенных в чистой культуре.
7. В некоторых случаях, например, при раневой гнойной инфекции или термических осложненных ожогах, когда процесс вызывается ассоциацией микроорганизмов, практикуется определение чувствительности сразу всей ассоциации. Однако, эти данные надо рассматривать как сугубо ориентировочные, которые необходимо дополнить исследованием чувствительности раздельно у каждого из членов ассоциации.
8. В отдельных случаях определение чувствительности микроорганизмов к антибактериальным препаратам может проводиться при первичном посеве материала на питательные среды. Это возможно тогда, когда возбудитель находится в исследуемом материале и в достаточно большом количестве (например, в гное из закрытых очагов).
Выбор методов определения чувствительности микроорганизмов к химиотерапевтическим препаратам
Определение чувствительности микроорганизмов к химиотерапевтическим препаратам в настоящее время может проводиться методом диффузии в агар с применением бумажных дисков или методом разведений, представленным двумя модификациями - метод разведений в плотной питательной среде и метод разведений в жидкой питательной среде. Применяются также и ускоренные методы определения чувствительности, среди которых есть как методы диффузии, так и методы разведений.Выбор метода зависит от цели исследования и возможностей лаборатории, выполняющей исследования.Метод диффузии в агар с применением дисков следует расценивать как метод качественный. Благодаря простоте, скорости и легкости исполнения он является основным при определении чувствительности микроорганизмов к химиотерапевтическим препаратам практическими лабораториями.Метод разведений - наиболее точный количественный метод. Он должен применяться в научно-исследовательской работе, при проведении международных исследований, а также в особенно важных случаях в лабораториях областных, краевых и республиканских санэпидстанций и в некоторых лабораториях лечебно-профилактических учреждений.Методом разведений в плотной питательной среде рациональнее пользоваться при необходимости исследовать одновременно большое количество культур, так как на чашку с плотной средой можно посеять одновременно несколько штаммов. Необходимо отметить также большую точность метода разведений в плотной среде, при котором определяется чувствительность к препарату большинства вариантов микробной популяции, в то время как при использовании жидкой среды определяется чувствительность наиболее устойчивых вариантов.Ускоренные методы служат дополнением к основным вышеназванным методам.Определение чувствительности микроорганизмов к сульфамидам затруднено тем, что большинство питательных сред, применяемых для определения лекарственной устойчивости микроорганизмов, для этих препаратов не годится: эти среды содержат значительное количество метаболитов, которые являются антагонистами сульфамидов (РАВА, фолиевая кислота и т.п.). Поэтому определение чувствительности микробов к сульфамидам производят методом разведений на специальных средах. Для определения чувствительности к сульфамидам энтеробактерий рекомендуется среда Биргера и Зац, а бактерий кокковой группы - среда Ланди, которые могут применяться как жидкими, так и агаризированными. В связи с существованием перекрестной устойчивости микроорганизмов к большинству сульфамидов при определении чувствительности возбудителей к этим препаратам достаточно проверить чувствительность к одному какому-либо сульфамиду - например, норсульфазолу.Для облегчения сравнения полученных результатов и их правильной оценки необходимо при определении чувствительности микроорганизмов к химиотерапевтическим препаратам любым методом обеспечить наиболее стандартные условия постановки опыта.
1.1.1. Определение чувствительности микроорганизмов к антибиотикам методом диффузии в агар с применением бумажных дисков
Принцип. На поверхность питательного агара в чашках Петри, засеянного испытуемыми микробами, наносят бумажные диски, пропитанные антибиотиками, и чашки инкубируют при 37°С. Наличие зоны задержки роста микробов вокруг дисков свидетельствует о чувствительности возбудителя к препарату, отсутствие зоны задержки роста - об устойчивости.Компоненты.
1. Диски. Для исследования могут быть использованы только стандартные заводские диски. Во флаконах с дисками, пропитанными нестойкими к влаге антибиотиками, находится силикагель, который является хорошим влагоуловителем и показателем влажности во флаконе (при увлажнении силикагель меняет свою окраску с синей на розовую). Диски из флаконов, в которых силикагель окрашен в коричневый или розовый цвет, не используются. Диски хранят в сухом темном месте при температуре не выше 20°С. После вскрытия флакона дисками можно пользоваться не более месяца.
2. Питательные среды.
а) Среда на переваре Хоттингера с содержанием 120-140 мг% аминного азота, 1-2% агара, pH 7,2-7,4.
б) Казеиново-дрожжевая среда с таким же содержанием аминного азота и агара и значением pH.
в) Мясо-пептонная среда с таким же содержанием агара и pH.В случае необходимости в среду может быть добавлено 5% крови или сыворотки, что отрицательного влияния на результаты анализа не оказывает.Ход определения. В стерильные чашки Петри диаметром 100 мм, расположенные на горизонтальной поверхности, наливают 20 мл расплавленного питательного агара. Перед посевом поверхность среды должна быть подсушена для того, чтобы посевной материал мог легко всасываться. В качестве посевного материала может быть использована суточная бульонная культура (при интенсивном росте допускается использование 4-5-часовой культуры, при медленном росте - 2-3-суточной культуры) или 1-млрд-суспензии, приготовленной с агаровой культуры. 1 мл бактериальной взвеси наносится на поверхность агара и равномерно распределяется путем покачивания чашки с последующим отсасыванием избытка жидкости пипеткой.В тех случаях, когда допускается постановка теста с испытуемым материалом (гной, раневое отделяемое и др.), последний наносят на поверхность питательного агара и равномерно растирают по поверхности среды стерильным шпателем. Одновременно исследуемый материал засевают для выделения чистой культуры и последующей постановки теста с чистой культурой. При монокультуре исследование можно не повторять.
Чашки подсушивают в течение 30-40 минут при комнатной температуре. Затем на поверхность засеянной среды пинцетом накладывают диски, пропитанные различными антибиотиками. В каждой чашке может быть испытано действие нескольких антибиотиков (до 5-6). Диски накладывают на поверхность агара плотно для тесного контакта со средой, следя за тем, чтобы не были положены 2 сцепленных между собой диска. Диски размещают на равном расстоянии один от другого и примерно на 2 см от края чашки. Чашки ставят в термостат перевернутыми кверху дном или вкладывают под крышку чашки кружок фильтровальной бумаги, чтобы избежать размывания газона конденсационной водой, и инкубируют при 37°С в течение 18-ти часов. Если исследуемый вид микроорганизмов растет медленно, инкубацию продлевают до 48-72 часов или более, в зависимости от появления роста в контроле.Оценка результатов. С помощью линейки или измерителя и миллиметровой бумаги определяют диаметр зон задержки роста микробов вокруг дисков, включая диаметр самого диска. Единичные колонии или тонкая пленка роста микроорганизмов внутри зоны задержки роста не учитывают. Отсутствие зон задержки роста микробов вокруг дисков указывает на отсутствие чувствительности микроба к данному антибиотику. При зоне задержки роста микроба диаметром до 10 мм штамм расценивается как мало чувствительный. Зона задержки роста микроба более 10 мм указывает на чувствительность штамма. Чем больше зона задержки роста, тем выше чувствительность микроорганизмов к антибиотику. В ответе должно быть написано, какой чувствительностью обладает исследуемая культура, а не размер зоны задержки роста.
1.1.2. Определение чувствительности микроорганизмов к антибиотикам методом разведения в бульоне
Принцип. Готовят серию разведения антибиотиков в питательной среде и вносят в каждое разведение антибиотика исследуемую культуру. После определенного периода инкубации отмечают наличие или отсутствие роста микробов. Метод позволяет определить минимальную концентрацию антибиотика, ингибирующую рост изучаемого микроба.Компоненты.
1. Питательные среды: мясо-пептонный бульон или бульон на переваре Хоттингера с содержанием 120-140 мг% аминного азота, pH 7,2-7,4. Если исследуемые микроорганизмы не растут на простых средах, допускается использование специальных сред, например, бульона Мартена для дифтерийных микробов, жидкой среды Сабуро для грибков и т.п.
2. Основные растворы антибиотиков. Порошок антибиотика (желательно стандарта антибиотика) взвешивают и растворяют в стерильной дистиллированной воде так, чтобы получить определенную концентрацию антибиотика. Удобной концентрацией для основного раствора является 2000 мкг/мл или ед/мл. Некоторые антибиотики не растворяются водой в такой концентрации, для них нужен специальный растворитель. Например, эритромицин и левомицетин растворяют в минимальном количестве этилового спирта, а затем разводят стерильной дистиллированной водой. Основные растворы антибиотиков стабильны при хранении в холодильнике в течение 1 недели.Подготовка к определению. Приготовление разведений антибиотиков. Разведение антибиотиков готовят путем разведения основного раствора антибиотика бульоном согласно представленной схеме (табл.2). Диапазон серии разведений зависит от установленных критериев чувствительности, она может быть начата и закончена на различных этапах. Пользуются отдельной пипеткой для приготовления основного раствора и его добавления к 1-й пробирке, затем отдельной пипеткой для каждой группы разведений: 2-3-4 пробирки, 5-6-7 пробирки и т.д. Полученные растворы антибиотиков разливают в стерильные пробирки по 1 мл. Для этого может быть использована одна пипетка - сначала разливают растворы более разведенные, затем более концентрированные. Можно готовить и двукратные разведения антибиотиков в бульоне в объеме 1 мл, но обязательно использовав отдельную пипетку для каждого разведения.Ход определения. Для заражения применяют бульонную культуру в логарифмической или ранней стационарной фазе роста, т.е. для большинства видов микроорганизмов 18-часовую культуру. Для видов микроорганизмов, рост которых замедлен, используют 48-часовую культуру. Можно пользоваться агаровыми культурами. Культуру стандартизуют и разводят бульоном до 10

Таблица 2
Схема приготовления разведений антибиотиков для метода серийных разведений в бульоне
| NN п/п | Указания для приготовления разведения антибиотиков | Концентрация антибиотика в полученном р-ре в ед/мл или мкг/мл | Окончательная концентр. антибиотика в мкг/мл или ед/мл в смеси 1 мл инокулята в бульоне |
| 1 | 2 мл р-ра с конц. антиб. 2000 мкг/мл | 256 | 128 |
| или ед/мл + 13,62 мл бульона | |||
| 2 | 2 мл р-ра с конц. антиб. 256 мкг/мл | 128 | 64 |
| или ед/мл + 2 мл бульона | |||
| 3 | 1 мл - " - + 3 мл - " - | 64 | 32 |
| 4 | 1 мл - " - + 7 мл - " - | 32 | 16 |
docs.cntd.ru
Расшифровка чувствительности к антибиотикам: о чем говорит анализ?
Читать оригинал публикации на mjusli.ru
Анализы на чувствительность к антибиотикам в медицине называют бактериальным посевом. Эти методы позволяют определить возбудителя заболевания и его концентрацию в организме. Цель анализа – выявить в полученном материале вредные микроорганизмы, чтобы в дальнейшем решить задачи насчет специфического лечения.
Выделив микроорганизмы, проводят антибиотикограмму – определение чувствительности обнаруженных микробов к бактериофагам и антибактериальным препаратам.
Методы лабораторного определения чувствительности бактерий к антибиотикам
Преимущества бакпосева
Метод отличается высокой специфичностью – не наблюдается перекрестных ложных реакций. Есть возможность исследовать любую биологическую жидкость. Проводится он в целях определения чувствительности выявленного микроба к лечебным средствам, что позволяет применять самую эффективную терапию.
Недостатки
Результат получают не сразу. Требования к забору материала высокие. Персонал лаборатории должен быть высококвалифицированным.

Показания для бактериологического посева
Этим методом широко пользуются в медицинской практике, особенно при инфекционных заболеваниях, в гинекологии, хирургии, урологии, онкологии, отоларингологии и пр.
Абсолютным показанием являются любые воспалительные заболевания органов и систем, подозрение на сепсис.
Материал для исследования
Исследовать могут следующие материалы: слизь из зева, носоглотки, цервикального канал, уретры; мокроты; кал; урину; кровь; секрет простаты; грудное молоко; желчь; спинномозговую жидкость; содержимое кист; раневое отделяемое.
Какие организмы определяют посредством бактериологического исследования?
Слизь из носа и зева может содержать: гемолитические стрептококки, пневмококки, золотистый стафилококк, коринобактерии дифтерии, менингококк, гемофильную палочку, листерии.
В кале могут выделить:
- кишечную группу бактерий – сальмонеллы, шигеллы, иерсинии;
- тифопаратифозную группу;
- условно-патогенных возбудителей кишечных инфекций;
- анаэробных микробов; возбудителей пищевых инфекций;
- обследовать на дисбактериоз кишечника.
В биопунктате, гнойном отделяемом и содержимом ран выделяют:
- псевдомонады;
- синегнойные палочки.
Урогенитальную слизь исследуют так:
- на наличие возбудителей половых инфекций – гонококк, грибы, трихомонады, уреаплазму, листерии, микоплазму;
- на бактериальную флору.
Кровь могут исследовать на стерильность. Грудное молоко, секрет простаты, мочу, мазки, раневое отделяемое, суставная жидкость, желчь – эти материалы могут быть обследованы на обсемененность (бактериальную флору).
Посев на флору и ее чувствительность к антибиотикам: процесс исследования
Собранный материал помещают в специальные среды. В зависимости от необходимого результата посев делают в разные среды. К примеру, в избирательная или элективная среда, примером которой является свернутая лошадиная сыворотка для обнаружения возбудителя дифтерии или же среда с солями желчных кислот/селенитом для определения возбудителя кишечных инфекций.

Другой вариант – дифференциально-диагностические среды, которые применяют для расшифровки бактериальных культур.
Если есть необходимость, делают пересев с жидкой на твердую питательную среду, чтобы идентифицировать колонии.
После этого питательную среду помещают в термостат, где создают благоприятные условия для жизнедеятельности возбудителей заболеваний. При этом задают конкретное время, влажность и температуру.
После извлечения образца из термостата проводят контрольный осмотр выросших колоний микробов (культура микроорганизмов). Если есть необходимость, проводится микроскопия полученного материала со специальной окраской. Контрольный осмотр – оценка формы, цвета, плотности колоний.
В заключение проводится подсчет возбудителей. В лабораторной практике используется понятие колониеобразующая единица (КОЕ) – одна микробная клетка, которая способна образовать колонию, или же видимая колония микробов. Показатель КОЕ позволяет определить количество микробов в образце или определить их концентрацию. Подсчет КОЕ может проводиться разными методами.
Как сдавать анализ на чувствительность к антибиотикам
Качество теста зависит от нескольких факторов, включая соблюдение правил при заборе материала для исследований. Посуда и инструменты должны быть стерильными! В противном случае происходит контаминация (происходит обсеменение бактериями, не имеющих клинического значения), что делает тест бессмысленным.
Если человек принимает антибиотики, посев не будет точным. Прием таковых нужно прекратить за 10 суток до предполагаемой даты анализа. Также нужно сообщить лечащему врачу о приеме любых медикаментозных средств.
Доставка в лабораторию должна быть очень быстрой, не допускается высыхание материала и изменение его кислотности.
К примеру, кал нужно доставлять в теплом виде.
- Забор мочи проводится после утренних гигиенических процедур. Собирают среднюю порцию урины. Объем мочи – 10-15 мл. посуда должна быть стерильной. В лабораторию ее нужно доставить за 2 часа;
- Если назначен мазок из носа или зева: нельзя чистить зубы, полоскать рот/нос дезинфекторами, есть и пить;
- Забор кала проводят утром стерильной лопаткой в такую же посуду. Объем – 15-30 г. Не допускается попадание в него мочи. Максимальное время доставки – 5 часов. Не допускается замораживание. Кал собирают без слабительных и клизм;
- Кровь берут до антибиотикотерапии. Минимальное количество – 5 мл для детей, не меньше 15 мл взрослым;
- Проба мокрот берется утром натощак. Предварительно полощут рот и чистят зубы. Доставляют в лабораторию максимум за 1 час;
- Грудное молоко собирают после водных процедур. Кожу около соска обрабатывают спиртом. Сцеживают 15 мл молока, затем последующие 5 мл выдавливают в стерильный контейнер. Доставляют его за 2 часа;
- Мазок половых органов: забор осуществляют минимум через 14 с момента окончания менструаций, не раньше месяца после курса антибиотиков. Не мочиться на протяжении 2 часов женщинам и 5-6 часов до пробы мужчинам.
Внутрикожная проба: определение на чувствительность к антибиотикам
Данный анализ проводят с целью определения аллергии у человека на конкретный медикамент. Это позволяет после выявления бактерий и определения их чувствительности к антибиотику подобрать лечение. Но если у человека имеются какие-либо противопоказания к таким лекарствам, проводится внутрикожная проба, чтобы снизить риск развития побочных реакций.
Результат исследования слизи из носоглотки готов спустя 5-7 суток, испражнения – 4-7, урогенитальный соскоб– 7, посев на общую флору – 4-7, кровь на стерильность – 10.
Расшифровка анализа чувствительности к антибиотикам
Учитывают качество и количество, то есть сам факт наличия микробов, так и их концентрацию. Расшифровка результатов проводится очень простым методом.
В исследуемом материале выделяют несколько степеней роста микроорганизмов (обсемененность).
- Первая степень – рост отсутствует;
- вторая степень – рост на твердой среде до 10 колоний;
- третья – до 100;
- четвертая – больше 100 колоний.
Результаты очень важны при выявлении условно-патогенной микрофлоры, так как 1 и 2 степени не считаются причинами заболевания, а просто свидетельствуют о загрязненности исследуемого материала, однако 3 и 4 степень указывают на причину воспаления. При выделении патогенной флоры учитывают абсолютно все колонии.
Результаты подсчета КОЕ/мл расшифровывают следующим методом:
- 103/мл – одна колония;
- 104/мл – от одной до пяти;
- 105/мл – от 5;
- 106/мл – больше 15.
Количество колоний важно для определения степени патологии и контроля проводимой терапии.
Чувствительность к антибиотикам: буквы s и r в анализе
Важной составляющей диагностики и лечения является определение чувствительности возбудителя к антибактериальным препаратам. Набор антибиотиков, к которому резистентный или чувствителен возбудитель, называют антибиотикограммой. Чувствительность микроорганизма – это когда антибиотик подавляет его размножение. Резистентность – это устойчивость бактерии, то есть лекарство никак на нем не отразится. Антибиотикограмма выдается в конкретных единицах измерения – минимальной ингибитирующей концентрации (МИК).

Как видите, исследованием данного вопроса может заниматься искючительно пофильный специалист. Здоровья вам и хорошего самочувствия!
lenta.co
Определение чувствительности микроорганизмов к антибиотикам и бактериофагам
Определение чувствительности микроорганизмов к антибиотикам и бактериофагам

Культуральное бактериологическое исследование (посев на питательные среды, бак.посев) позволяет получить непосредственно культуру микроорганизма – возбудителя данной инфекции. Выделив культуру, ее можно во-первых точно идентифицировать (определить вид микроба), а во-вторых определить ее чувствительность к лекарственным препаратам – антибиотикам (антибактериальным препаратам) и бактериофагам.
Этот тест (определение антибиотикочувствительности, «подтитровка антибиотиков» ) имеет важнейшее значение для последующего лечения, т.к. позволяет выбрать препарат, максимально подходящий для лечения конкретного возбудителя. Необходимость такого анализа связана с тем, что даже бактерии одного вида, но выделенные от разных животных (разные штаммы) могут отличаться по спектру чувствительности. Сегодня выпускаются десятки наименований антибиотиков (АБ), относящиеся по своему строению к различным группам. Например, для лечения стафилококка могут применяться препараты как минимум девяти фармакологических групп, каждая из которых включает несколько наименований. Выбрать из них оптимальный для лечения конкретного возбудителя – непростая задача, решить которую невозможно без определения антибиотикочувствительности.
Характерная особенность современных возбудителей – частая встречаемость высокоустойчивых (мультирезистентных) штаммов микроорганизмов. Они проявляют устойчивость к действию различных групп антибиотиков – одной или сразу нескольких. Например, грамотрицательные бактерии семейства Enterobacteriaceae (к ним относятся такие распространенные возбудители как Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa) образуют ферменты БЛРС – беталактамазы расширенного спектра. Эти ферменты нейтрализуют действие бета-лактамных антибиотиков (пенициллинов и цефалоспоринов). У штаммов стафилококков также существует механизм резистентности, маркерным признаком которого является устойчивость к метициллину. МРС – метициллинрезистентные стафилококки – проявляют устойчивость ко всем бета-лактамным антибиотикам. Среди энтерококков растет количество полирезистентных штаммов, устойчивых в том числе и к ванкомицину (препарату выбора).
В ходе бактериологического исследования в компетентных лабораториях у микроорганизмов проводят определение указанных маркеров резистентности, и дают результаты в заключении. Это дает информацию лечащему врачу, антибиотики каких групп будут эффективны, какие будут бесполезны. В лабораторной практике нередки случаи, когда возбудитель устойчив почти ко всем протестированным антибиотикам, за исключением 1-2 препаратов.
Определение чувствительности к антибиотикам обычно проводят диско-диффузионным методом, используя стандартизованные питательные среды и стандартизованные диски с антибиотиками. Используют как минимум два набора антибиотиков – один для грамположительных (Гр+), другой для грамотрицательных (Гр-) микроорганизмов (что соблюдается увы не во всех лабораториях). Также наборы антибиотиков несколько отличаются в зависимости от источника происхождения – например, для культур из мочи обычно ставят дополнительно несколько препаратов-«уросептиков».
Если от животного выделено несколько культур микроорганизмов, чувствительность к АБ определяется индивидуально к каждой из них. Результаты лаборатория выдает по общепринятой градации: «Ч» — культура чувствительна к антибиотику; «П» — промежуточный уровень чувствительности; «У» — культура устойчива.
Также целесообразно определение чувствительности к бактериофагам – препаратам вирусной природы, имеющим ряд преимуществ по сравнению с антибиотиками, хорошо себя зарекомендовавшим в гуманной медицине. Существуют моновалентные и поливалентные бактериофаги. В лабораториях обычно определяют чувствительность к трем бактериофагам – одному моновалентному (специфичному для конкретного возбудителя) и двум поливалентным, включающим комплекс фагов против нескольких видов бактерий. Без лабораторного определения чувствительность возбудителя к бактериофагам практически непредсказуема. Фаг может «работать» очень хорошо, а может быть вообще не активным против данной культуры микроба.
Итак, по результатам лабораторного бактериологического исследования врач получает на руки информацию, необходимую для эффективного лечения конкретной инфекции. Традиционный подход (сначала лечим тем, что есть, потом диагностируем) постепенно уходит из практики. Препараты широкого спектра, на которые привыкли надеяться лечащие врачи, все чаще дают сбои, в силу распространения высокоустойчивых штаммов. Кроме того, лечение животного неспецифическим антибиотиком ведет к тому, что нормальная микрофлора организма сильно страдает, а патогенная флора адаптируется к антибиотикам, приобретает устойчивость, и вылечить такое животное в дальнейшем будет крайне сложно.
Очевидно что в экстренных случаях, при критических состояниях у врача нет времени дожидаться результатов анализов. Однако в остальных случаях потраченное на анализ время окупится гораздо быстрее, чем длительное лечение неэффективным препаратом.
Определение чувствительности грибов к противогрибковым препаратам (антимикотикам) также проводится в некоторых диагностических бак.лабораториях и имеет свои особенности, о чем Вы можете прочитать в соответствующем разделе сайта БакПосев-Вет.Ру.
Источник: www.bakposev-vet.ru
bakposev-vet.ru
Методы определения чувствительности к антибиотикам
Из-за формирования антибиотикоустойчивых популяций микроорганизмов с целью эффективного лечения необходимо предварительно определять чувствительность данного антибиотика к выделенной культуре возбудителя.
Основными методами определения антибиотикочувствительности бактерий in vitro является метод серийных разведений, диффузии в агар (бумажных дисков), определение способности к продукции бета- лактамазы, in vivo- на модели безмикробных животных, определение концентрации антибиотиков в крови и моче. Выбор метода зависит от цели исследования и возможностей лаборатории. Диско-диффузный метод следует рассматривать как качественный. Методы разведения – более точные количественные способы исследования. Их применяют в особо важных практических случаях и научно-исследовательской работе.
Метод диффузии в агар с применением стандартных дисков, пропитанных различными антибиотиками в определенных концентрациях (зависят от терапевтической дозы и соотвествуют рекомендациям ВОЗ). Основан на использовании стандартных питательных сред, дисков и методов. Оценка результатов связана с существованием зависимости между размером зоны подавления роста исследуемых культур вокруг дисков и значениями минимальных подавляющих концентраций (МПК)соответствующих антибиотиков (чувствительностью микроорганизмов). Имеются специальные таблицы для оценки результатов, в соответствии с которыми культуры определяют как чувствительные, умеренно устойчивые и устойчивые (резистентные) к тестируемому антибиотику.
Для исследования можно использовать стандартные питательные среды: отечественные среды АГВ №1, №2 и зарубежные – Мюллер-Хинтон агар.
На поверхность подсушенной питательной среды в чашке Петри наносят 1мл исследуемой культуры (18-20 часовой бульонной культуры или стомиллионной суспензии из агаровой культуры., равномерно распределяют путем покачивания чашки и удаляют если необходимо избыток пипеткой. После посева чашки подсушивают при комнатной температуре 10-15 мин. Диски с антибиотиками накладывают пинцетом на равном расстоянии друг от друга и на 2 см от края чашки (на одну чашку не более 6 дисков). Чашки сразу ставят в термостат вверх дном и инкубируют при 370С в течение 18-20 ч (время инкубации зависит от вида исследуемого микроорганизма. Для учета результатов чашки помещают кверху дном на темную матовую поверхность и освещают настольной лампой под углом 450. Допускается учет в проходящем свете. С помощью линейки измеряют диаметры зон задержки роста вокруг дисков, включая диаметр дисков, с точностью до 1мм. Оценку результатов проводят по таблице. В медицинской практике обычно определяют 3 группы микроорганизмов по чувствительности к антибиотикам: чувствительные, среднечувствительные и устойчивые. «Чувствительные» микроорганизмы, когда обычно применяемые дозы антибиотика могут обеспечить лечебный эффект. «Среднечувствительные» микроорганизмы – повышенные дозы антибиотика могут обеспечить лечебный эффеки. «Устойчивые» микроорганизмы – нельзя рассчитывать на лечебный эффект.
Метод серийных разведений антибиотиков позволяет более точно определить МПК, однако из-за громоздкости применяется реже.
Для исследования используют мясопептонный бульон. Основные растворы антибиотиков приготавливают путем взвешивания их порошка и растворения его в стерильной дистиллированной воде, чтобы получить определенную удобную концентрацию. Разведения антибиотиков готовят путем разбавления основного раствора антибиотика бульоном. Для этого используют 11 пробирок. В первую пробирку вносят 2 мл раствора антибиотика и переносят по 1 мл раствора антибиотика из первой пробирки в каждую последующую. Затем суточную бульонную культуру разводят до 105 – 106 микробных тел в 1 мл и вносят по 1 мл во все пробирки с разведениями антибиотика. Посевы инкубируют при 370С. Отмечают первую пробирку с задержкой роста микробов.
Бета- лактамазный тест (определение способности к образованию бета- лактамаз) чаще определяют методом дисков с нитроцефином - цефалоспорином, изменяющим окраску дисков при гидролизе. Положительный тест свидетельствует о резистентности бактерий ко всем бета- лактамаза- чувствительным пенициллинам.
Ускоренные методы определения чувствительности.
Ускоренное определение чувствительности микроорганизмов к антибиотикам осуществляется некоторыми зарубежными автоматизированными системами микробиологических исследований. В кюветах панели содержатся дегидрированные субстраты или диски с антибиотиками. Каждый антибиотик в кювете представлен в одной концентрации, соответствующей критерию принадлежности бактерий к группе «чувствительных» к антибиотику. Одновременно тестируется 20 и более антибиотиков. После внесения взвеси испытуемых бактерий посевы инкубируют при 35-370С в течение 4-5 часов. Результаты регистрируют спектрофотометрически или кондуктометрически сразу при появлении размножения бактерий в контроле без антибиотика.
studfiles.net
Определение чувствительности к антибиотикам — Мегаобучалка
Используют стандартный диско-диффузионный метод, предложенный Керби и Бауэром (метод Керби – Бауэра). В качестве примера приводим рекомендуемый набор дисков с антибиотиками и критерии учета полученных результатов для стафилококков (табл. 1, 2). Средой для постановки теста на чувствительность является среда Мюллера – Хинтона с добавлением 4 – 5% NaCl.
Таблица 1. Набор дисков с антибактериальными препаратами и диаметр зон ингибирования роста для определения чувствительности штаммов стафилококка при отрицательном результате определения бета-лактамаз
| Антибактериальный препарат | Диск/ концентрация | Диаметр ингибирования зон | ||
| R | I | S | ||
| Оксациллин | ОХ/1 | <10 | 11-12 | >13 |
| Бензилпенициллин | P/1O | <28 | - | >29 |
| Ампициллин | AM/10 | <28 | - | >29 |
| Цефазолин | CZ/30 | <14 | 15-17 | >18 |
| Примечание. Здесь и в табл. 2: R - устойчивые; I - промежуточные; S - чувствительные. |
Таблица 2. Набор дисков с антибактериальными препаратами и диаметр зон ингибирования роста для определения чувствительности штаммов стафилококка при положительном результате определения бета-лактамаз
| Антибактериальный препарат | Диск/ концентрация | Диаметр ингибирования зон | ||
| R | I | S | ||
| Оксациллин | ОХ/1 | <10 | 11-12 | >13 |
| Эритромицин | E/15 | <13 | 14-22 | >23 |
| Клиндамицин | CM/2 | <14 | 15-20 | >21 |
| Ко-тримоксазол | CXT | <10 | 11-15 | >16 |
| Фузидиевая кислота | FA/10 | <15 | 16-21 | >22 |
| Ванкомицин | VA/30 | - | - | >15 |
| Амоксициллин/клавуланат | AmC/30 | <19 | - | >20 |
| Цефуроксим | CXM/30 | <14 | 15-22 | >23 |
Для определения чувствительности стафилококков предварительно проводят определение наличия/отсутствия у тестируемого штамма ферментов, получивших название "бета-лактамаз" – диск с нитроцефином (BBL, США). При отсутствии данных ферментов используют диски. При наличии у тестируемого штамма данных ферментов необходимо использовать диски, представленные в табл.2. Предлагаемый подход к тестированию чувствительности штаммов стафилококка важен для правильной интерпретации полученных результатов чувствительности:
1. При отсутствии бета-лактамазообразования и сохранении чувствительности к оксациллину препаратами выбора являются природные аминопенициллины и цефалоспорины I поколения.
2. При наличии бета-лактамазообразования и сохранении чувствительности к оксациллину препаратами выбора являются оксациллин, защищенные пенициллины, цефалоспорины II поколения.
3. При наличии бета-лактамазообразования и отсутствии чувствительности к оксациллину бета-лактамные антибиотики (включая карбапенемы) являются клинически не эффективными. Применяются препараты других групп.
Стрептококки (в том числе пневмококк). Для этих микроорганизмов метод
Керби – Бауэра имеет свои ограничения:
1. Он корректен лишь для пневмококка. И только в том случае, если тот показывает чувствительность к оксациллину (нагрузка 1 мкг). В случае снижения чувствительности к оксациллину необходимо использовать метод Е-теста или серийных разведений.
2. При использовании метода Керби – Бауэра для тестирования стрептококков в среду Мюллера – Хинтона необходимо добавлять 5% бараньей крови/эритроцитов.
3. Стрептококки группы "viridans" не рекомендуется тестировать на чувствительность к антибиотикам этим методом из-за отсутствия воспроизводимых результатов.
Псевдомонады и другие неферментирующие грамотрицательные бактерии. Ограничения диско-диффузионного метода:
1. Стандартизован лишь для синегнойной палочки и бактерий рода Аcinetobacter.
2. При исследовании чувствительности других псевдомонад и неферментирующих грамотрицательных бактерий необходимо использовать Е-тест или метод серийных разведений.
Гемофильные палочки.
Ограничения диско-диффузионного метода:
1. Для постановки чувствительности диско-диффузионным методом должна использоваться специальная среда – HTM (Haemophilus Test Medium).
Дрожжеподобные грибы рода Кандида и др
Ограничения диско-диффузионного метода:
1. Используется специальные среды – казитоновый агар и полусинтетический агар для тестирования грибов.
2. Более достоверные результаты получаются при использовании метода серийных разведений.
Таким образом, резюмируя сказанное, можно сделать следующие выводы:
− При определении чувствительности к антибактериальным препаратам штаммов энтеробактерий и стафилококков рекомендуется использовать метод Керби – Бауэра.
− При определении чувствительности к антибактериальным препаратам штаммов стрептококков (в том числе пневмококка), неферментирующих грамотрицательных палочек, гемофильных палочек и дрожжеподобных грибов рекомендуется использовать коммерческие тест-системы ("стрипы"), представляющие собой набор тех или иных антибиотиков, представленных в двух концентрациях. Это метод (breakpoint) позволяет избежать трудоемкости стандартного метода серийных разведений, но не теряет при этом его главного достоинства – количественного определения минимальной подавляющей концентрации препарата, соответствующей терапевтической концентрации антибиотика в организме.
Отдельно подчеркиваем особенности микробиологической диагностики легионелл, микоплазм и хламидий.
− Легионеллезы в настоящее время микробиологически диагностируются с помощью реакции иммунофлюоресценции (РИФ) на определение антигена.
− Первичная атипичная пневмония (микоплазменная) также микробиологически подтверждается с помощью ИФА выявление антител (IgG , IgM).
− Хламидийные пневмонии диагностируются микробиологически как РИФ, так и ИФА (антигены и антитела (IgG)).
Streptococcus pneumoniae - самый частый возбудитель внебольничной пневмонии у лиц всех возрастных групп.
Пневмококк (вид Streptococcus pneumoniae) как представитель рода Streptococcus семейства Streptococcaceae имеет ряд характерных для других стрептококков свойств.
Пневмококк является грамположительным диплококком. oбычно ланцетовидным, имеющим полисахаридную капсулу, с размером клеток 1х0,2 мкм. Спор не образует, неподвижен.
S.pneumoniae является комменсалом верхних дыхательных путей. Вместе с тем пневмококк относят к потенциально патогенным микроорганизмам, поскольку он является ведущим этиологическим агентом острых внегоспитальных пневмоний, менингитов, средних отитов и синуситов; может вызывать также первичный сепсис, инфекции другой локализации.
Пневмококк растет при температуре 25-41 °С, оптимум - 37°С. Факультативный анаэроб со сложными пищевыми потребностями, однако 10-20% штаммов требуют анаэробных условий при первичной изоляции, особенно из крови. Пневмококк не имеет каталазы, ферментирует глюкозу по гексозомонофосфатному пути с образованием молочной кислоты. Для полноценного роста пневмококку необходимы высокомолекулярные пептоны, комплекс витаминов, пурины, пиримидины, холин. Все это обеспечивают сердечно-мозговые питательные среды, которые являются наилучшими для культивирования. Оптимум рН среды составляет 7,8. Нуждается в экзогенной каталазе, поэтому обязательным компонентом среды должна быть кровь, которая обогащает среду питательными веществами, обеспечивает буферное действие, поддерживает соответствующий кислородный баланс, а железо гемоглобина действует, как каталаза. Стимулируют рост низкая концентрация глюкозы (не более 0,1%), повышенное парциальное давление СО, (5-10%i).
На плотных питательных средах пневмококк образует небольшие, диаметром 1-2 мм, колонии с α-гемолизом, часто сходные со стрептококковыми (приподнятый край и центр - "блюдце"), но более прозрачные и влажные. Мукоидные колонии образуют 3-й и 37-й серотипы. Атипичные штаммы растут в виде шероховатых колоний (R-форма). В анаэробных условиях вокруг колоний некоторых штаммов может наблюдаться а-гемолиз. При росте на жидких питательных средах пневмококк образует диффузное помутнение.
Биохимическая активность характеризуется ферментацией ряда сахаров с образованием молочной кислоты: медленно ферментируются спирты и пентозы. Отличительным свойством S.pneumoniae является ферментация инулина.
В антигенном отношении пневмококк неоднороден. Известно 4 типа пневмококковых антигенов: капсульный полисахаридный антиген, С-полисахаридный антиген. М- и R-протенновые антигены. Капсульный полисахарид является типоспецифическим антигеном. Он обладает антифагоцитарной активностью (фактор вирулентности) и обусловливает выработку протективных антител. На основании различий в капсульных антигенах пневмококки разделены на 84 сероварианта. Определение капсульного антигена используется в диагностических целях и при создании вакцин. Атипичные штаммы не продуцируют капсульный полисахарид. С-полисахарид входит в состав клеточной стенки и обусловливает видоспецифнчность клеток (общий для всех пневмококков). М-протеиновый антиген - это типоспецифический белок, аналогичный М-белку стрептококков, однако он не имеет антифагоцитарных свойств. R-протеиновый антиген был выделен из шероховатых штаммов пневмококка.
Для исследования на пневмококки используются кровь, ликвор, плевральная и перикардиальная жидкости, пурулентная мокрота, биопсийный, бронхоскопический и другой клинический материал в зависимости от локализации очага инфекции. При выявлении бактерионосителей исследуют фарингеальные мазки. В случае предполагаемой задержки до обработки и исследования материал следует хранить при 4°С.
Наиболее ценным и в то же время простым экспрессным методом диагностики является реакция набухания капсулы по Найфельду. Для постановки теста готовят мазок из исследуемого материала с добавлением капли поливалентной пневмококковой антикапсульной сыворотки (омни-сыворотка) и капли метиленовой сини, после чего накрывают покровным стеклом и микроскопируют. В положительных случаях наблюдается guellung-эффект; капсула вокруг клеток пневмококка значительно увеличивается в размерах и становится четко видимой. Этот феномен позволяет легко выявлять и дифференцировать пневмококки от других стрептококков.
Идентификацию пневмококка после культивирования на питательных средах осуществляют по совокупности морфологических, физиологических, культуральных, серологических и биохимических свойств. Для дифференциации пневмококка от других видов зеленящих стрептококков используют два основных теста - лизис желчью или дезоксихолатами и чувствительность к оптохину (этилгидрокупреина гидрохлориду).
Тест лизиса желчью. Основан на способности 10% р-ра желчи крупного рогатого скота и 2% р-ра дезоксихолата или таурохолата натрия лизировать молодую культуру пневмококка. Желчь понижает поверхностное натяжение между бактериальной мембраной и средой, что ведет к ускорению естественного аутолитического процесса. Постановку теста осуществляют либо в жидкой среде, когда в две пробирки, одна из которых опытная, содержащая 10% желчный бульон, другая - контрольная с сывороточным бульоном, вносится испытуемая бульонная культура и выдерживается до часа, либо на плотной среде путем нанесения на газонный рост или изолированные колонии капли желчного бульона (дезоксихолата) и выдерживания, пока не высохнет капля (5-10 мин).
При лизисе пневмококка на жидкой среде отмечается просветление в опытной пробирке; на плотной среде на месте капли рост уплотняется или исчезает совсем. Рост стрептококков остается интактным.
Оптохиновый тест. Тест основан на различной чувствительности пневмококка и зеленящих стрептококков к оптохину. Рост пневмококка ингибируется концентрациями оптохина не более 5 мкг/мл При применении бумажных дисков, импрегнированных оптохином. которые накладывают на инокулированные штрихом чашки с кровяным агаром, зона ингибнрования роста S.pneumoniae после 18-часовой инкубации, значительно превышает зону -стрептококков.
Серотипирование пневмококков. Антигенную структуру пневмокков изучают в реакции агглютинации на стекле или в реакции Найфельда с использованием набора сывороток к капсульным полисахаридам. Набор состоит из ”omni”-сыворотки (антитела ко всем 84 сероварам), поливалентных пуловых сывороток, содержащих антитела к 4-7 сероварам и серогруппам, имеющим буквенное обозначение (от "А"до I"), и типовых сывороток, входящих в пулы. Идентификация может быть также осуществлена с использованием коммерческих реагентов для реакции коагглютинацни.
megaobuchalka.ru
 |  |  |  |  |  |  |  |  |  |  |  |  |  |  |
 Пример видео 3 Пример видео 3 |  Пример видео 2 Пример видео 2 |  Пример видео 6 Пример видео 6 |  Пример видео 1 Пример видео 1 |  Пример видео 5 Пример видео 5 |  Пример видео 4 Пример видео 4 |
Администрация муниципального образования «Городское поселение – г.Осташков»


























