Толерантность хлебопекарных дрожжей
НПО "Альтернатива" - 5.3. Факторы роста и выживания дрожжей
К основным факторам роста и выживания дрожжей в пищевых продуктах относятся свойства продуктов (внутренние факторы), условия окружающей среды (внешние факторы), физиологические характеристики дрожжей и биологические взаимодействия между дрожжами, а также между дрожжами и другими микроорганизмами (неявные факторы).
5.3.1. Метаболическая активность дрожжей
Подобно грибам дрожжи являются аэробными организмами и необходимые питательные вещества получают посредством дыхания. Вопреки распространенному мнению только около половины видов дрожжей способны сбраживать сахара. Такие дрожжи являются факультативными анаэробами, а спиртовое брожение – наиболее замечательное свойство ряда дрожжей. Наиболее энергично сбраживают сахар дрожжи рода Saccharomyces – они выдерживают высокие концентрации этанола (до 15% об.). Этанол (этиловый спирт) является ценным компонентом различных пищевых продуктов, а другой основной конечный продукт деятельности дрожжей, диоксид углерода, может способствовать их порче.
В анаэробных условиях дрожжи могут утилизировать самые простые пищевые вещества – моно- и дисахариды, органические кислоты, спирты и аминокислоты, и лишь ограниченное число сахаров (главным образом гексозы и некоторые дисахариды) могут использоваться ими в качестве субстратов брожения. Далеко не все дрожжи способны гидролизовывать макромолекулы. В частности, только немногие виды дрожжей обладают амилолитическими ферментами, необходимыми для гидролиза крахмала. К частичному гидролизу крахмала способна особая разновидность Saccharomyces cerevisiaе (часто рассматриваемая как отдельный вид) – Saccharomyces diastaticus. Наиболее активные амилолитические дрожжи Debaryomyces occidentalis и Saccharomycopsis fibuligera могут вызывать порчу хлеба и других хлебопекарных изделий (с появлением дефекта, называемого «меловом хлебом»). В дрожжевых клетках зачастую присутствуют липолитические и протеолитические ферменты, но их активность редко бывает достаточной для интенсивного гидролиза. Причиной липолитической и протеолитической порчи мясных и молочных продуктов могут являться дрожжи Yarrowia lipolytica, а также некоторые виды Candida и Rhodotorula.
5.3.2. Условия роста дрожжей
Популяции дрожжей, которые размножаются почкованием или делением, имеют типичную, такую же как и у бактерий, кривую роста, которая в зависимости от скорости размножения может быть разделена на лаг-фазу (фазу задержки), экспоненциальную и стационарную фазы, фазу замедления и отмирания. Продолжительность этих фаз в значительной степени зависит от внутренних и внешних факторов, при этом скорость роста максимальна в экспоненциальной фазе. В целом скорость роста у дрожжей ниже, чем у бактерий, но выше, чем при нитевидном росте плесеней. Это дает бактериям конкурентное преимущество над дрожжами в большинстве естественных мест обитания и в пищевых продуктах. Тем не менее в случае благоприятных условии рост дрожжей может легко опередить рост бактерии. При оптимальных условиях время генерации дрожжей составляет примерно от 1 до 2 ч, что соответствует скорости роста 0,70-0,35 ч-1. Отдельные дрожжи (например, Zygosaccharomyces и Galactomyces) растут медленнее, и их время генерации может составлять 4-8 ч и более (табл. 5.3). При неблагоприятных условиях скорость роста снижается и увеличивается продолжительность лаг-фазы.
Дрожжи способны расти при определенных условиях внешней среды (температура, влажность, рН и др.). Вне определенного диапазона для каждого из этих параметров их рост останавливается, однако при этом они способны выживать. Дрожжи значительно различаются по своей устойчивости к неблагоприятным факторам, изучение которых представляется особенно важным, поскольку создает основу для разработки методов защиты пищевых продуктов от возможной дрожжевой порчи.
Температурный диапазон роста дрожжей в целом охватывает интервал от нескольких градусов ниже 0°С и до нескольких градусов выше 40°С. Большинство дрожжей являются мезофильными и лучше растут при температуре 25-30°С, тогда как у психротрофных дрожжей оптимальная температура роста ниже 20°С. Некоторые дрожжи могут расти только при температурах до 45–47°С, по даже их нельзя считать истинными термофилами (табл. 5.4). В случае отклонения от оптимальной температуры (табл. 5.5) скорость роста падает. Большинство дрожжей более толерантно к пониженной активности воды (αω), чем бактерии, и для большинства ДВПП минимальное значение αω,необходимое для их роста, находится в интервале 0,90-0.95. Некоторые виды дрожжей, например Zygosaccharomyces rouxii, могут расти при αωниже 0,70 и при высокой концентрации сахара или соли. Их обычно относят к осмофильным дрожжам, но точнее их называть ксеротолерантными (табл. 5.6).
Таблица 5.3. Характеристики роста некоторых ДВПП*
| Виды | Лаг-фаза, ч | Время генерации, ч |
| Debaryomyces hansenii | 3 | 0,8 |
| Hanseniaspora uvarum | 3 | 0,9 |
| Zygosaccharomyces bailii | 4 | 1,4 |
| Schizosaccharomyces pombe | 4 | 2,4 |
| Galactomyces geotrichum | 10 | 3,6 |
* Аэрируемые культуры в питательной среде при рН 4 и 30°С
Таблица 5.4. Пороговые значения максимальных температур роста некоторых пищевых дрожжей*
| Виды | Температура, °С |
| Kluyveromyces marxianus | 46 |
| Pichia guillermondii | 41 |
| Metschnikowia pulcherrima | 38 |
| Candida zeylanoides | 33 |
| Leucosporidium sottii | 23 |
* Средние значения по 7-16 штаммам, измеренные в искусственной среде.
Таблица 5.5. Влияние температуры на рост винных дрожжей (по [2])
| Виды дрожжей | Время удвоения, ч, при температуре | ||
| 10 °C | 15° С | 25 °С | |
| Saccharomyces cerevisiae | 17,3 | 8,7 | 4,1 |
| Hanseniaspora uvarum | 11,6 | 5,8 | 3,3 |
| Candida stellata | 17,3 | 5,8 | 5,3 |
| Torulaspora delbrueckii | 23,1 | 9,9 | 4,3 |
| Issatchenkia orientalis | 69,3 | 23,1 | 8,7 |
Таблица 5.6. Пороговые значения активности воды для некоторых пищевых дрожжей*
| Виды | Минимальное значение αωв растворе: | |
| Глюкозы | NaCl | |
| Candida versatilis | 0,79 | 0,84 |
| Debaryomyces hansenii | 0,84 | 0,84 |
| 0,90 | 0,95 | |
| Torulaspora delbrueckii | 0,86 | 0,90 |
| Zygosaccharomyces rouxii | 0,79 | 0,86 |
* Получены на бульонных культурах, выращиваемых при комнатной температуре до 120 сут.
Дрожжи выживают и широком диапазоне кислотности среды и хорошо растут при значениях рН от 3 до 10. В целом дрожжи предпочитают слегка кислую среду, а оптимальные значения рН находятся в интервале 4,5 - 5,5. Они характеризуются отличной устойчивостью к изменению кислотности, и некоторые виды могут расти и кислой среде при рН 1,5.
Влияние экологических факторов на рост дрожжей зависит от их сочетания: например, при низких значениях αωминимальная температура роста возрастает, а в случае низких Температур для роста дрожжей требуются одновременно более высокие минимальные значения рН и αω. Этот факт служит основой для разработки различных комбинированных методов консервирования. В этом отношении важную роль играет взаимодействие дрожжей с другими микроорганизмами, хотя практическое значение биологического взаимодействия все еще изучено недостаточно. Дрожжи и молочнокислые бактерии одновременно встречаются как во многих естественных местах обитания, так и в пищевых системах, поскольку у них общие экологические детерминанты.
alternativa-sar.ru
Значение глутатиона в дрожжах для хлебопекарных свойств
Влияние эквивалентного количеству дрожжей содержания глутатиона на процесс приготовления хлебобулочных изделий
Тот факт, что присутствующий в дрожжах глутатион влияет на качество теста и выпечки, принимают в расчет только тогда, когда вопрос касается лишь определенных процессов, например, замораживание и размораживание полуфабрикатов. Поэтому была поставлена цель – измерить содержание глутатиона в той форме, в которой он содержится в коммерческих штаммах свежих и сухих дрожжей, и исследовать, изменяются ли технологические свойства в процессе выпечки.
Ферментация, начинающаяся в тестовых заготовках при замешивании и заканчивающаяся в процессе выпекания, является важным технологическим этапом, от которого зависит способность хлебобулочных изделий к разрыхлению. Для приготовления хлеба и мелкоштучных изделий, как правило, применяют биологические методы. Такие методы диктуют, что пористость и конечный объем изделий помимо стартовых культур главным образом регулируется внесением дрожжей (в большинстве случаев Saccharomyces cerevisiae). Кроме требуемого подъема заготовок, обусловленного выделением СО2, при внесении дрожжей происходит перенос в тесто органических соединений, таких как кислоты, предшественники ароматизаторов или, напротив, редуцирующие вещества, например, глутатион (GSH). Глутатион представляет собой так называемый псевдопептид, образующийся в клетке дрожжей из аминокислот: глутаминовой кислоты, цистеина и глицина. В то время как GSH в клетке дрожжей выполняет множество физиологически значимых функций, свободная тиоловая группа (SH) цистеина способствует образованию глютеновой сетки. И если целенаправленное внесение ограниченного количества глутатиона делает тесто более мягким и пластичным, то диффузия неконтролируемого количества глутатиона из дрожжевых клеток ведет к ослаблению свойств теста, в том числе, негативно влияет на его пригодность к переработке в машине и влечет потерю объема. С этим же явлением связаны, например, процессы замораживания-размораживания теста. Из-за высокого перепада температур клетки дрожжей повреждаются, вследствие чего глутатион получает возможность диффундировать из клеток в тесто и влиять на качество изделий. Поэтому цель заключалась в измерении содержания водорастворимого глутатиона в коммерческих штаммах гранулированных и сухих дрожжей и исследовании его влияния на тесто и готовые изделия.
Зависимость между количеством мертвых клеток и содержанием водорастворимого глутатиона в дрожжах
Чтобы исследовать влияние эквивалентного количеству дрожжей содержания глутатиона на свойства теста и выпечки, предварительно было определено содержание водорастворимого глутатиона в 27 видах коммерческих гранулированных (6) и сухих (21) дрожжей методом спектральной фотометрии. Дополнительно, чтобы установить, есть ли зависимость между количеством мертвых клеток и содержанием глутатиона, было проанализировано процентное содержание мертвых клеток. Для этого мертвые клетки окрасили метиленовым синим. Как видно на рисунке 1, между количеством мертвых клеток дрожжей и содержанием глутатиона существует линейная зависимость (R2 = 0,8483). Небольшое отклонение от линейности не является неожиданным, так как хотя содержание глутатиона в клетке дрожжей повышается по мере увеличения интенсивности воздействия (критические температуры, окисление, гиперосмолярность), определяющим фактором высвобождения глутатиона и его перехода в водную фазу в рабочем растворе или тесте является растворение/разрушение стенки клетки (лизис). Это означает, что, несмотря на обусловленную стрессом инактивацию метаболизма, лизис происходит не во всех случаях, и поэтому GSH, способствующий релаксации теста, отсутствует. Привлекают внимание различия между образцами свежих и сухих дрожжей. Если в свежих дрожжах, обычно используемых при приготовлении хлебобулочных изделий, общее количество мертвых клеток составляло от 1,8 до 8,8 %, то в сухих дрожжах процентное содержание мертвых клеток достигало 75,0 %. Соответственно, максимальное количество глутатиона в свежих дрожжах составляло 10,5 мг/г дрожжей (в сухом веществе; в СВ), в образцах же сухих дрожжей максимальное количество составляло 81,2 мг/г дрожжей (в СВ). Примечательно, что существенные различия были выявлены не только между образцами свежих и сухих дрожжей, но и между образцами одной и той же марки, изготовленными в разное время. Максимальная разница между количествами мертвых клеток в процентном выражении составляла 75 %, а наибольшее расхождение между содержанием глутатиона в образцах доходило до 91 %. Хотя полученные результаты указывают на отклонения в процессе производства, этот простой и быстрый способ определения количества мертвых клеток позволяет с уверенностью предположить, какое количество глутатиона содержится в той или иной партии дрожжей. Дальнейшие исследования влияния эквивалентного количеству дрожжей содержания глутатиона на образование теста и качество готовых изделий велись на образцах с содержанием GSH: 0,0; 7,3; 27,8; 58,6 и 76,2 мг на 100 г муки.
Зависимость между содержанием водорастворимого глутатиона (мг/г дрожжей (в СВ)) в 27 видах коммерческих свежих (●) и сухих дрожжей (■) и количеством мертвых клеток. Между содержанием водорастворимого глутатиона и процентным количеством мертвых клеток есть линейная зависимость (R2 = 0,8483).
Эквивалентное количеству дрожжей содержание глутатиона влияет на стабильность теста при замешивании
Влияние эквивалентного количеству дрожжей содержания глутатиона на время образования теста (А), стабильность теста (В) и релаксацию теста (С) исследовали, замешивая тесто в течение 20 минут в чаше объемом 50 г тестомесильной машины с z-образными лопастями (DoughLab; Perten, Hägersten, Schweden). Рецептура теста включала 50 г муки (содержание влаги доведено до 14 %), 29,4 г деминерализованной воды и разное содержание глутатиона (0,0; 3,65; 13,9; 28,8 и 38,1 мг). Все три представленные на рисунке 2 (А-С) кривые изменения показателей свидетельствуют о том, что при увеличении эквивалентного количеству дрожжей содержания глутатиона отмечается дестабилизация структуры. Если для образования теста без содержания GSH требовалось 7,4 минуты, то при повышении содержания GSH на 67 % время образования теста сократилось до 2,5 минут. Хотя, на первый взгляд, ускоренное образование теста кажется положительным фактором, дестабилизирующий характер воздействия проявляется, прежде всего, в асимптотическом падении стабильности теста (В) с 17,5 до 1,8 минут и, соответственно, релаксации теста (С), которая изменилась с 26 до 282 Farinograph®-единиц (FE). Как правило, если показатель релаксации теста превышает 70 FE, тесто становится влажным и очень липким, что практически исключает возможность его дальнейшей переработки. Как ранее и предполагали Pyler und Gorton (1988), вносимый в составе сухих дрожжей глутатион ощутимо нарушает стабильность теста во время замешивания [1]. Глутатион в свежих дрожжах, напротив, не оказывает какого-либо значимого влияния на образование теста. Кроме того, асимптотический характер изменения трех показателей позволяет сделать вывод о том, что масштаб вызванного присутствием GSH расщепления или ингибирования дисульфидных связей определяется содержанием глутатиона в муке [2].
Рисунок 2 - A Рисунок 2 - B Рисунок 2 - CВлияние эквивалентного количеству дрожжей содержания глутатиона (0,0; 7,3; 27,8; 58,6; 76,2 мг/100 г муки) на (A) время образования теста (●), (B) стабильность теста (■) и (C) релаксацию теста (▲) в тестомесильной машине DoughLab. Кривые времени образования теста (R2 = 0,9861) и стабильности теста (R2 = 0,9659) характеризуются асимптотическим падением. Показатель релаксация теста, напротив, растет при увеличении содержания глутатиона (R2 = 0,9269). Указаны средние значения со стандартным отклонением (n = 3).
На рисунке 3 схематично показано, как единичные молекулы глутатиона (объекты желтого цвета) переходят из разрушенных клеток дрожжей (обведенные пунктирной линией овальные объекты) в водную фазу теста во время замешивания и, таким образом, влияют на образование теста. Этот процесс не затрагивает живые неповрежденные клетки (обведенные сплошной линией овальные объекты). При замешивании молекулы GSH остаются внутри клеток.
Рисунок 3Изменение глютеновой сетки вследствие диффундированы глутатиона из легированных клеток дрожжей в тесто при замешивании. На рисунке изображена структура теста. Она состоит из глютеновой сетки со свободными тимоловыми группами (SH) и бисульфитными связями (R-SS-R), а также активных (обведенные сплошной линией овальные объекты светло-голубого цвета с молекулами GSH, выделенными желтым цветом) и разрушенных (обведенные пунктирной линией овальные объекты голубого цвета) клеток дрожжей. Из разрушенных клеток дрожжей молекулы GSH переходят в водную фазу теста и препятствуют развитию, то есть вызывают расщепление, существующих дисульфидных связей (схематическое изображение под лупой).
Снижение газоудерживающей способности вследствие внесения эквивалентного количеству дрожжей объема глутатиона
Для изучения влияния эквивалентного количеству дрожжей содержания глутатиона на газоудерживающую способность во время брожения использовали химическую систему разрыхления теста, состоявшую из носителя кислоты SAPP 10 (кислый пирофосфат натрия; предоставлен компанией Chemischer Fabrik Budenheim KG) и носителя диоксида углерода NaHCO3 (гидрокарбонат натрия). Химический метод разрыхления помог предотвратить изменение структуры, вызываемое продуктами обмена дрожжей. Кроме того, благодаря протеканию химической реакции между SAPP 10 и NaHCO3 можно исследовать влияние GSH в условиях, когда известно количество CO2 и скорость образования. Для измерения образования теста при брожении использовали реоферментометр F3 (Chopin, Villeneuve-La-Garenne Cedex, Франция). Замес вели в тестомесильной машине с z-образными лопастями, объем воды на замес теста и количество глутатиона добавили из расчета на 300 г муки (влажность муки 14 %). Принимая во внимание число нейтрализации (ЧН) носителя кислоты (ЧН SAPP 10: 72), в химическую систему разрыхления внесли из 9,9 г SAPP 10 и 7,3 г NaHCO3. После замешивания в тестомесильной машине с z-образными лопастями 315 г теста переместили в реоферментометр и выдержали при температуре 30 °C в течение 3 часов. Во время отдыха теста среди прочих показателей определили максимальную высоту теста Hm и высоту h в конце цикла измерений. На основании полученных результатов рассчитали коэффициент релаксации теста SC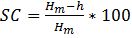
Зависимость коэффициента релаксации теста SC от эквивалентного количеству дрожжей содержания глутатиона (0,0; 7,3; 27,8; 58,6; 76,2 мг/100 г муки) в реоферментометре. Чтобы исключить влияние метаболизма дрожжей на структуру, вместо штамма S. cerevisiae использовали химическую систему разрыхления, состоявшую из SAPP 10 (кислый пирофосфат натрия) и NaHCO3 (гидрокарбонат натрия). В расчете на 100 г муки отмерили 2,5 г NaHCO3 и 3,5 г SAPP 10 (число нейтрализации: 72), чтобы средний объем CO2 составил 666,0 ± 30 мл (n = 3). Очевидно, что по мере увеличения содержания глутатиона наблюдается экспоненциальный рост (R2 = 0,9642) коэффициента релаксации теста до 20,4 %. Указаны средние значения со стандартным отклонением (n = 3).
За время трехчасового отдыха теста в реоферментометре образовалось примерно 670 мл CO2. Это приблизительно соответствует тому объему, который высвобождают 0,5 % сухих дрожжей или 1,5 % свежих дрожжей. Из этого можно заключить, что применение химического разрыхлителя подходит для регулирования газообразующей способности дрожжей [3]. На рисунке 3 видно, что в присутствии глутатиона в количестве 0,0–58,6 мг на 100 г коэффициент релаксации теста увеличивается всего лишь с 0,0 % до 6,0 %, из чего следует, что происходит небольшое изменение газоудерживающей способности теста, имеющее, однако, важное значение. Такое изменение говорит о том, что структура теста уже ослаблена настолько, что подъем теста при выпекании вряд ли сохранится. Если содержание глутатиона повышается до 76,2 мг на 100 г муки, что может произойти при использовании дрожжей, в которых количество мертвых клеток составляет примерно 60 %, то значение коэффициента релаксации может вырасти до 20,5 %. Это означает, что во время брожения тесто будет терять примерно пятую часть максимально возможного объема. Кроме неизбежной при этом потери CO2, в частности, значительно изменится и глютеновая сетка.
Изменение удельного объема хлеба в зависимости от эквивалентного количеству дрожжей содержания глутатиона
Влияние глутатиона на удельный объем пшеничного хлеба тоже исследовали на примере продуктов с химическим разрыхлителем. Разрыхлительная система состояла из носителя кислоты глюконо-дельта-лактона (число нейтрализации ЧН: 30) и носителя диоксида углерода (NaHCO3). Исследовали эффект скорости газообразования во время отдыха теста в присутствии GSH. Скорость газообразования (280–2.160 мл CO2 в час) регулировали путем изменения содержания глюкон-дельта-лактона, 1,5 – 12,9 г на 100 г муки. Требуемое для нейтрализации носителя кислоты содержание NaHCO3 варьировалось в пределах 0,45–3,87 г на 100 г муки. Замесили тестовые заготовки весом 250 г каждая, уложили в формы для выпечки и поместили формы в расстоечный шкаф на 30 минут для отдыха. Расстоявшиеся заготовки выпекали в течение 18 минут при температуре 230 °C. После охлаждения продолжительностью 1 час измерили вес и объем изделий с помощью инструмента Volscan (TexVol Instruments, Viken, Швеция) и рассчитали удельный объем хлеба (объем на вес).
Рисунок 5Зависимость удельного объема хлеба (мг/л) от скорости образования СО2. Приготовили образцы пшеничного теста c эквивалентным количеству дрожжей содержанием глутатиона: 0,0 мг (●), 7,3 мг (■), 27,6 мг (▲) и 76,2 мг (◆) на 100 г муки. Скорость газообразования регулировали химической системой разрыхления, состоявшей из глюкон-дельта-лактона (1,5-12,9 г на 100 г муки, число нейтрализации: 30) и гидрокарбоната натрия (0,45–3,87 г на 100 г муки). Скорость газообразования рассчитали на основании показаний реоферментометра. Характер кривой свидетельствует о полиномиальном изменении удельного объема хлеба (R20,0 мг GSH = 0,9149; R27,3 мг GSH = 0,9725; R227,6 мг GSH = 0,9773; R276,2 мг GSH = 0,9865). Указаны средние значения со стандартным отклонением (n = 3).
По представленным на рисунке 5 кривым можно проследить влияние эквивалентного количеству дрожжей содержания глутатиона (0,0; 7,3; 27,6 и 76,2 мг на 100 г муки) в комбинации с разной скоростью газообразования на объем готовых изделий. Если в образцах без глутатиона максимальный удельный объем составил 3,8 мл/г, то при наибольшем содержании глутатиона уменьшение объема выпечки составило 24 % (2,4 мл/г). Также очевидно, что за исключением образцов с наибольшим содержанием GSH повышение скорости газообразования способствует увеличению объема выпечки. Причина заключается в большем объеме СО2, который закономерно увеличивается с ростом скорости газообразования при том же времени отдыха теста. Кроме того, проведенные эксперименты подтверждают предположения многочисленных групп исследователей о том, что процессы замораживания-размораживания полуфабрикатов способствуют наступлению структурных изменений в хлебобулочных изделиях, вследствие чего содержание глутатиона в тесте увеличивается [4-7].
Резюме и выводы
Структура пшеничного теста в значительной степени зависит от эквивалентного количеству дрожжей содержания глутатиона. В частности содержащийся в сухих дрожжах глутатион (5,4-81,2 мг на 1 г дрожжей (в СВ)) влечет уменьшение стабильности теста (-67 %) и повышает релаксацию теста (+91 %). При наибольшем содержании GSH, которое в исследовании составляло 76,2 мг на 100 г муки, тесто становится излишне липким и влажным, что ограничивает его пригодность для дальнейшей переработки. Кроме того, было выявлено, что релаксационное воздействие глутатиона зависит от конечного количества тиоловых групп глютена. Помимо этого, исследование процесса брожения в реоферментометре показало, что определенная комбинация GSH и СО2 может заранее ослабить структуру теста. Это подтверждают измерения коэффициента релаксации теста. Структура не выдерживает подъема в печи, то есть быстрого высвобождения СО2, действия паров воды и этанола в начальной фазе выпечки, что приводит к опадению еще не сформировавшейся структуры мякиша. В частности, высокое содержание разрушенных клеток в коммерческих штаммах сухих дрожжей в результате приводит к значительному уменьшению (макс. 20 %) удельного объема. Использование жидких или прессованных дрожжей, напротив, не влияет ни на структуру теста, ни на структуру готовых изделий. Только при замораживании-размораживании и в процессе связанного с ними отмирания клеток содержание GSH в таких дрожжах может сравняться с содержанием GSH в сухих дрожжах, поэтому рекомендуется применять методы регулирования процесса, использовать хлебопекарные улучшители и/или устойчивые к воздействию холода дрожжи. В целом исследования показали, что структурные свойства теста и хлебобулочных изделий в процессе приготовления определяет не только процесс образования СО2, являющийся первичной функцией дрожжей, но другие метаболиты.
- Pyler, E.J. and L.A. Gorton, Yeasts, Molds and Bacteria, in Baking Science and Technology: Fundamentals and Ingredients 1988, Sosland Publishing Company: Kansas City.
- Grosch, W. and H. Wieser, Redox Reactions in Wheat Dough as Affected by Ascorbic Acid. Journal of Cereal Science, 1999. 29(1): p. 1-16.
- Verheyen, C., M. Jekle, and T. Becker, Effects of Saccharomyces cerevisiae on the structural kinetics of wheat dough during fermentation. LWT - Food Science and Technology, 2014. 58(1): p. 194-202.
- Autio, K. and E. Sinda, Frozen Doughs: Rheological Changes and Yeast Viability. Cereal Chemistry, 1992. 69(4): p. 409-413.
- Bayrock, D. and W.M. Ingledew, Fluidized bed drying of baker's yeast: moisture levels, drying rates, and viability changes during drying. Food Research International, 1997. 30(6): p. 407-415.
- Meziani, S., et al., Influence of yeast and frozen storage on rheological, structural and microbial quality of frozen sweet dough. Journal of Food Engineering, 2012. 109(3): p. 538-544.
- Wolt, M.J. and B.L. D'Appolonia, Factors Involved in the stability of Frozen Dough. I. The Influence of Yeast Reducing Compounds on Frozen-Dough Stability. Cereal Chemistry, 1984. 61(3): p. 209-212.
Назад
www.chlebiwipetschka.com
Новый штамм дрожжей с повышенной толерантностью к холоду
Ученые университета Манчестера нашли новый вид дрожжей, который может помочь пивоварам делать более качественные лагеры. Исследователи, работающие совместно с Национальным банком дрожжевых культур (NCYC), говорят, что открытая ими культура – это новый член семьи Saccharomyces, близкий родственник пивных и хлебопекарных дрожжей. Однако этот вид был найден на высоте – более чем в 1000 метрах над уровнем моря, на дубовом дереве в Сент-Обане, у подножия Французских Альп. Чтобы выжить на такой высоте, дрожжи развили способность выдерживать более низкие температуры, чем большинство других известных штаммов Saccharomyces. — Эта способность может заинтересовать пивоваров, так как для лагеров нужны дрожжи, работающие при низких температурах. Кроме того, открывается возможность создавать новые гибриды с улучшенными биотехнологическими качествами, — говорит профессор Даниела Дельнери из института биотехнологии университета Манчестера. Дрожжи имеют и другие сферы применения в биотехнологии, а значит, дрожжи, которые могут работать при более низкой температуре, открывают новые возможности для использования. — Это первый новый вид пивных дрожжей, открытый с 2011 года. Очень интересно найти новый вид Saccharomyces, так как это еще больше расширяет генетическое разнообразие дрожжей, которым мы можем пользоваться, — говорит доктор Стив Джеймс из NCYC. Помимо пивоварения и хлебопечения, дрожжи играют важную роль в науке – это одна из лучших моделей для изучения того, как работают клетки. Они находятся на передовой синтетической биологии – развивающей области науки, создающей биологические системы. Коллекции вроде NCYC, где хранится более 4 тысяч различных штаммов дрожжей, — это генетические банки, откуда ученые могут выбрать гены, отвечающие за множество различных функций, и внедрить их в новые виды дрожжей. При этом, несмотря на то, что в дрожжевых банках по всему миру содержатся тысячи штаммов дрожжей, ученые оценивают, что идентифицирована лишь малая доля существующих штаммов – возможно, около 10%. В ходе поисков манчестерские ученые нашли десятки штаммов дрожжей на дубовых деревьях (богатом источнике дрожжей) и окружающей их почве. Затем они изолировали толерантные к холоду штаммы и вместе со специалистами по таксономии дрожжей из NCYC изучили то, что нашли. Как оказалось, большинство выделенных штаммов уже были известны, но два штамма после секвенирования генома и генетического тестирования оказались совершенно новыми. — Было невероятно круто, когда мы поняли, что открыли новые толерантные к холоду штаммы, которые к тому же могут эффективно сбраживать мальтозу, — добавляет доктор Самина Насиб из университета Манчестера. Материал взят с сайта profibeer.ru

100bochek.com
 |  |  |  |  |  |  |  |  |  |  |  |  |  |  |
 Пример видео 3 Пример видео 3 |  Пример видео 2 Пример видео 2 |  Пример видео 6 Пример видео 6 |  Пример видео 1 Пример видео 1 |  Пример видео 5 Пример видео 5 |  Пример видео 4 Пример видео 4 |
Администрация муниципального образования «Городское поселение – г.Осташков»























