Определение β-каротина в нативной биомассе дрожжей Rhodotorula glutinis spp. Родоторула дрожжи
Штамм дрожжей rhodotorula glutinis - продуцент каротиноидов
Использование: микробиологическая промышленность, получение каротиноидов. Сущность изобретения: штамм дрожжей Rhodotorula glutinis выделен из почвы. Депонирован во Всероссийской коллекции промышленных микроорганизмов под номером ВКПМ V-2210.
При культивировании штамма на питательной среде, включающей источники углерода, азота и минеральные соли, в глубинных условиях получают биомассу, содержащую 1450-1500 мкг/г каротиноидов.
Изобретение относится к микробиологической промышленности и касается нового штамма дрожжей, используемого для получения каротиноидов, применяемых в животноводстве, пищевой промышленности и медицине. Известны различные продуценты каротиноидов: дрожжи, грибы, бактерии и микроводоросли. Описанные микроорганизмы отличаются как по уровню накопления каротиноидов и составу пигментного комплекса, так и по условиям культивирования и по видам используемого сырья. Известен штамм дрожжей Sporolobomyces pararosens T, растущий на среде гидролизат верхового торфа. На 5 сут культивирования штамм накапливает до 3200 мкг/л каротиноидов (авт. св. СССР N 391174, опубл. 1973). Недостатком данного штамма является невысокий уровень накопления каротиноидов и большая продолжительность процесса культивирования. Известен штамм дрожжей Rhodotorula glutinis Б-71, способный расти на молочной сыворотке (авт. св. СССР N 451743, опубл. 1975). Штамм устойчив к низким значениям pH и характеризуется полнотой усвоения лактозы. Однако данный штамм не обеспечивает высокого выхода каротиноидов. Наиболее близким к изобретению по технической сущности и достигаемому эффекту является штамм дрожжей Rhodotorula glutinis 214 (авт. св. СССР N 531844, опубл. 1976). Штамм дрожжей выращивают на минеральной среде с использованием в качестве источника углерода УГВ нефти 1-1,5 об.%, углеводы 2-4%, или этанол 1 об.% . При этом дрожжи накапливают до 819 мкг/г каротиноидов на среде с УГВ нефти и до 977 мкг/г каротиноидов на углеводной среде. Недостатком данного штамма является невысокий уровень накопления каротиноидов. Задача, стоящая перед авторами изобретения, заключалась в получении нового штамма дрожжей, способного накапливать значительные количества каротиноидов на различных источниках углерода. Технический результат изобретения заключается в получении нового штамма дрожжей Rhodotorula glutinis ВКПМ V-2210 с более высокой активностью каротинообразования. Штамм выделен из почвы методом накопительных культур на минеральной среде с добавлением в качестве источника углерода этанола и глюкозы и последующим рассевом на агаризованной среде сусло. Отбор штамма проводили по активности каротинообразования. Минеральная среда имела следующий состав: (Nh5)h3PO4-10 г/л, K2HPO4 10 г/л, MgSO4 0,7 г/л. Концентрация этанола в среде 0,4 об.%, глюкозы 0,5%. Хранят штамм на солодовом сусле-агаре при комнатной температуре при периодических пересевах (2-3 раза в год). Штамм хранят также на солодовом сусле-агаре под слоем вазелинового масла. Пересев осуществляют один раз в 2-3 года. Культурально-морфологические признаки. На мальтэкстракте 3-х дневная культура при 22oC имеет слегка овальные клетки размером 2,3-5,0 x 4,0-10,0 мкм. В жидкой культуре образуется тонкая пленка и небольшой осадок. На агаризованной среде мальтэкстракт клетки морфологически сходны с жидкой культурой. Колонии окрашиваются в ярко-розовый цвет, гладкие, блестящие с ровным краем. При выдерживании на агаризованной среде в течение месяца цвет колоний усиливается. После 7-10 дней образуется не ярко выраженный псевдомицелий. На кукурузном агаре образуется слабо развитый псевдомицелий. Старая культура может образовывать истинный мицелий с темной пигментацией. Физиолого-биохимические признаки. Брожение отсутствует. Культура ассимилирует галактозу, сахарозу, мальтозу, целлобиозу, трегалозу, рафинозу, D-ксилозу, L-арабинозу, рибитол, D-манитол, янтарную кислоту, лимонную кислоту. Не ассимилирует лактозу, растворимый крахмал, L-рамнозу, эритритол, инозитол. Утилизирует аммонийный и нитратный азот. Культура не нуждается в витаминах. На среде с 50% глюкозы не растет. Крахмал не накапливает. Мочевину разлагает. Растет при температуре 37oC. Оптимальная температура роста 30oC. Оптимум pH 5,0-5,5. Аэроб. Штамм непатогенен. Биотехнологическая характеристика. Штамм накапливает до 1500 мкг/г каротиноидов, при этом содержание - каротина составляет 50%. Состав засевной среды для качалочных колб: (Nh5)h3PO4 10 г/л, K2HPO4 10 г/л, MgSO4 0,7 г/л, FeSO4
 7h3O 12,5 мг/л, MnSO4
7h3O 12,5 мг/л, MnSO4 7h3O 12,5 мг/л, NaCl 6,3 мг/л. Штамм депонирован в коллекции Всероссийского музея промышленных микроорганизмов института ГосНИИгенетика, регистрационный номер ВКПМ V-2210. Пример 1. Штамм дрожжей выращивали в ферментере Yp 1 л на питательной среде вышеописанного состава. Процесс вели при температуре 30oC, pH 5,5. Титрование осуществляли 6% раствором аммиака. В качестве источника углерода использовали этиловый спирт. Время выращивания 72 ч. Концентрацию спирта в среде поддерживали 0,4 об.%. Содержание каротиноидов в биомассе составило 1500 мкг/г. Пример 2. Штамм дрожжей выращивали в ферментере Yp 1 л на питательной среде вышеописанного состава. В качестве источника углерода использовали ферментолизат ржаной муки следующего состава: содержание редуцирующих веществ 67 г/л, содержание сухих веществ 9,0%. Количество ферментолизата ржаной муки в среде 75 мл (из расчета, чтобы РВ не превышало 0,5%). Время выращивания 72 ч. Содержание каротиноидов в биомассе составило 1489 мкг/г. Пример 3. Штамм дрожжей выращивали в ферментере Yp 1 л на питательной среде вышеописанного состава. В качестве источника углерода использовали мелассу (содержание сахарозы в мелассе 43%, сумма сбраживаемых сахаров 44%, pH 6,5 ). Количество мелассы, подаваемой в ферментер составило 6,5 мл (из расчета, чтобы концентрация сахарозы в среде не превышала 0,3%). Время выращивания 72 ч. Содержание каротиноидов в биомассе составило 1450 мкг/г. Таким образом, предлагаемый штамм дрожжей Rhodotorula glutinis ВКПМ V-2210 способен накапливать значительные количества каротиноидов на различных источниках углерода.
7h3O 12,5 мг/л, NaCl 6,3 мг/л. Штамм депонирован в коллекции Всероссийского музея промышленных микроорганизмов института ГосНИИгенетика, регистрационный номер ВКПМ V-2210. Пример 1. Штамм дрожжей выращивали в ферментере Yp 1 л на питательной среде вышеописанного состава. Процесс вели при температуре 30oC, pH 5,5. Титрование осуществляли 6% раствором аммиака. В качестве источника углерода использовали этиловый спирт. Время выращивания 72 ч. Концентрацию спирта в среде поддерживали 0,4 об.%. Содержание каротиноидов в биомассе составило 1500 мкг/г. Пример 2. Штамм дрожжей выращивали в ферментере Yp 1 л на питательной среде вышеописанного состава. В качестве источника углерода использовали ферментолизат ржаной муки следующего состава: содержание редуцирующих веществ 67 г/л, содержание сухих веществ 9,0%. Количество ферментолизата ржаной муки в среде 75 мл (из расчета, чтобы РВ не превышало 0,5%). Время выращивания 72 ч. Содержание каротиноидов в биомассе составило 1489 мкг/г. Пример 3. Штамм дрожжей выращивали в ферментере Yp 1 л на питательной среде вышеописанного состава. В качестве источника углерода использовали мелассу (содержание сахарозы в мелассе 43%, сумма сбраживаемых сахаров 44%, pH 6,5 ). Количество мелассы, подаваемой в ферментер составило 6,5 мл (из расчета, чтобы концентрация сахарозы в среде не превышала 0,3%). Время выращивания 72 ч. Содержание каротиноидов в биомассе составило 1450 мкг/г. Таким образом, предлагаемый штамм дрожжей Rhodotorula glutinis ВКПМ V-2210 способен накапливать значительные количества каротиноидов на различных источниках углерода.www.findpatent.ru
| Описание | Грибы рода Rhodotorula — это несовершенные дрожжи базидиомицетного ряда, относящиеся к семейству Cryptococcaceae. Известно широкое распространение этих грибов в окружающей среде; они обнаруживаются в воздухе, морской воде, на растительном материале. Некоторые виды Rhodotorula выделяют от человека. Этот гриб может присутствовать на коже и на ногтях как сапрофит, может колонизировать респираторный и мочевыделительный тракты, конъюнктиву.Некоторые виды Rhodotoruia, а именно Rhodotorula rubra (син. Rhodotorula mucilaginosa) и Rhodotorula giutinis, составляют менее 0,5% культур дрожжей, выделяемых изо рта, и более 12% изолятов — из кала и ректальных тампонов. Ввиду частого выделения Rhodotorula из биосубстратов, контактирующих с внешней средой, факт наличия в них этого гриба имеет весьма ограниченное значение.По-иному оценивается обнаружение Rhodotorula в крови, костном мозге, спинно-мозговоп жидкости, т.е. в биосубстратах, не контактирующих с внешней средой, это важный признак для диагностики родоторулеза. Согласно каталогу грибов Ainsworth и Bisby, Rhodotorula относится к этиологическим агентам оппортунистических микозов и развивается в условиях нарушенной иммунной защиты и гомеостаза, как правило, в терминальной стадии длительно текущих процессов. Среди факторов риска наибольшее значение имеют опухоли и длительно стоящие внутривенные и перитониальные катетеры.В роде Rhodotorula различают от 8 до 18 видов, а в качестве патогенов называются Rhodotorula pillmanae, Rhodotorula pallida, Rhodotorula marina, Rhodotorula giutinis и Rhodotorula rubra. Среди системных микотических поражений эта инфекция относится к группе казуистически редких: описано несколько случаев поражения кожи, легких, почек, эндокарда, брюшины, печени, костного мозга, щеки, горла и единственное наблюдение родоторулезного менингита у мужчины с острой лейкемией. У ВИЧ-инфицированного ребенка был описан случай диссеминированного микоза, вызванного Rhodotorula nmmta.В 1960 году Riopedre и соавторы сообщили о выделении Rhodotorula rubra из спинно-мозговой жидкости, кала, мочи, глотки и кожи у трехмесячного ребенка, который находился в коматозном состоянии (диагноз не указан). Ряд работ посвящен сепсису, вызванному Rhodotorula у больных с сосудистыми катетерами, в том числе у одного ВИЧ-инфицированного больного. Все эти случаи демонстрируют достаточный потенциал Rhodotorula для инвазии тканей и показывают, что этот гриб может быть причиной серьезных системных микозов. Клиническая картина заболевания неспецифична и широко варьирует от легких до тяжелых форм. Для диагностики родоторулеза обязательным является выделение гриба при посеве биосубстрата на питательную среду |
gorchilin.com
Дрожжи семейства Rhodotorula sp. | Дерматология в России
Данные пациентаЦвет кожи:
II светлаяАнамнез заболеванияНаследственный анамнез:
Нет указаний на наследуемый характер заболеванияПродолжительность заболевания:
несколько месяцевТочный дебют заболевания:
01 янв 2016Дебют в возрасте:
В возрасте 16-20 летХарактер течения заболевания:
Хронический персистирующийЭпизоды заболевания (обострения):
Это единственный эпизод заболеванияАнамнез жизниВредные привычки:
Нет вредных привычекОбщие клинические данныеЖалобы при обращении:
На высыпания на теле.
Категории жалоб:
Сыпь на кожеStatus localisОписание сыпи:
В области боковых поверхностей тела, животе, лобка, пахово-бедренных складок крупные округлые и фестончатые пятна розового цвета с четкими границами, выраженным отрубевидным шелушением на поверхности . Симптом бенье (+), проба Бальзера (+).
Первичные элементы сыпи:
ПятноВторичные элементы сыпи:
ЧешуйкаГруппировка элементов сыпи:
Фестончатая / ПолициклическаяЛокализация высыпаний:
Локализация высыпаний:
ЖивотЛокализация высыпаний:
Паховая областьРаспространение сыпи:
Не указаноХарактер расположения сыпи:
На закрытых одеждой местахДиагнозКлинический диагноз:
Дерматофития гладкой кожи.Данные обследованияОбщие лабораторные анализы:
ВИЧ, гепатиты, сифилис, туберкулез исключены. КАК и Б/Х в пределах нормы.
Микробиологические исследования:
При микроскопии обнаружен мицелий микромицета. При посеве выделена культура Rhodotorula sp.
Периодически на м/о попадались пациенты с клинической картиной поражения кожи, напоминающей отрубевидный лишай (пятна розового или цвета кофе с молоком, отрубевидным шелушением и положительным симптомом Бальзера), но очень крупные и нередко поражающие пахово-бедренную область. Когда на прием пришел пациент с такими проявлениями, результаты обследования удивили. Правильно ли будет назвать такое поражение дерматомикозом гладкой кожи , или нужны дополнения с учетом выявленного возбудителя.
www.dermatology.ru
штамм дрожжей rhodotorula glutinis - продуцент каротиноидов - патент РФ 2103350

 7h3O 12,5 мг/л, MnSO4
7h3O 12,5 мг/л, MnSO4 7h3O 12,5 мг/л, NaCl 6,3 мг/л. Штамм депонирован в коллекции Всероссийского музея промышленных микроорганизмов института ГосНИИгенетика, регистрационный номер ВКПМ V-2210. Пример 1. Штамм дрожжей выращивали в ферментере Yp 1 л на питательной среде вышеописанного состава. Процесс вели при температуре 30oC, pH 5,5. Титрование осуществляли 6% раствором аммиака. В качестве источника углерода использовали этиловый спирт. Время выращивания 72 ч. Концентрацию спирта в среде поддерживали 0,4 об.%. Содержание каротиноидов в биомассе составило 1500 мкг/г. Пример 2. Штамм дрожжей выращивали в ферментере Yp 1 л на питательной среде вышеописанного состава. В качестве источника углерода использовали ферментолизат ржаной муки следующего состава: содержание редуцирующих веществ 67 г/л, содержание сухих веществ 9,0%. Количество ферментолизата ржаной муки в среде 75 мл (из расчета, чтобы РВ не превышало 0,5%). Время выращивания 72 ч. Содержание каротиноидов в биомассе составило 1489 мкг/г. Пример 3. Штамм дрожжей выращивали в ферментере Yp 1 л на питательной среде вышеописанного состава. В качестве источника углерода использовали мелассу (содержание сахарозы в мелассе 43%, сумма сбраживаемых сахаров 44%, pH 6,5 ). Количество мелассы, подаваемой в ферментер составило 6,5 мл (из расчета, чтобы концентрация сахарозы в среде не превышала 0,3%). Время выращивания 72 ч. Содержание каротиноидов в биомассе составило 1450 мкг/г. Таким образом, предлагаемый штамм дрожжей Rhodotorula glutinis ВКПМ V-2210 способен накапливать значительные количества каротиноидов на различных источниках углерода.
7h3O 12,5 мг/л, NaCl 6,3 мг/л. Штамм депонирован в коллекции Всероссийского музея промышленных микроорганизмов института ГосНИИгенетика, регистрационный номер ВКПМ V-2210. Пример 1. Штамм дрожжей выращивали в ферментере Yp 1 л на питательной среде вышеописанного состава. Процесс вели при температуре 30oC, pH 5,5. Титрование осуществляли 6% раствором аммиака. В качестве источника углерода использовали этиловый спирт. Время выращивания 72 ч. Концентрацию спирта в среде поддерживали 0,4 об.%. Содержание каротиноидов в биомассе составило 1500 мкг/г. Пример 2. Штамм дрожжей выращивали в ферментере Yp 1 л на питательной среде вышеописанного состава. В качестве источника углерода использовали ферментолизат ржаной муки следующего состава: содержание редуцирующих веществ 67 г/л, содержание сухих веществ 9,0%. Количество ферментолизата ржаной муки в среде 75 мл (из расчета, чтобы РВ не превышало 0,5%). Время выращивания 72 ч. Содержание каротиноидов в биомассе составило 1489 мкг/г. Пример 3. Штамм дрожжей выращивали в ферментере Yp 1 л на питательной среде вышеописанного состава. В качестве источника углерода использовали мелассу (содержание сахарозы в мелассе 43%, сумма сбраживаемых сахаров 44%, pH 6,5 ). Количество мелассы, подаваемой в ферментер составило 6,5 мл (из расчета, чтобы концентрация сахарозы в среде не превышала 0,3%). Время выращивания 72 ч. Содержание каротиноидов в биомассе составило 1450 мкг/г. Таким образом, предлагаемый штамм дрожжей Rhodotorula glutinis ВКПМ V-2210 способен накапливать значительные количества каротиноидов на различных источниках углерода. ФОРМУЛА ИЗОБРЕТЕНИЯ
Штамм дрожжей Rhodotorula glutinis ВКПМ У-2210 продуцент каротиноидов.www.freepatent.ru
Основными требованиями, предъявляемыми к расам дрожжей при производстве спирта являются:
Высокая бродильная активность. Спиртовые дрожжи должны образовывать максимум спирта;
Способность сбраживать как моносахара, так и дисахариды и некоторые декстрины;
Способность сбраживать растворы, содержащие довольно большие концентрации сахара;
Высокая кислотоустойчивость;
Способность осуществлять спиртовое брожение при высоком содержании спирта в растворе.
Микрофлора производственных дрожжей
Культурные дрожжи должны быть стойкими к инфицированию. Тем не менее, посторонние микроорганизмы попадают в засевные производственные дрожжи при неправильном ведении технологического процесса, при недостаточно тщательной мойке и дезинфекции оборудования и коммуникаций, несоблюдении санитарного режима в отделении чистых культур и т.д.
Чаще всего производственным дрожжам сопутствуют молочнокислые, уксуснокислые бактерии и дикие дрожжи, которые, так же как и культурные дрожжи, используют сахара питательной среды в качестве основного источника питания, что снижает выход спирта. Эти микроорганизмы образуют органические кислоты и другие продукты, которые могут отрицательно влиять на органолептические показатели готовой продукции (хлеба, пива) и бродильную активность культурных дрожжей. Хлебопекарные дрожжи, инфицированные посторонними микроорганизмами, имеют низкую ферментативную активность и стойкость.
Молочнокислые бактерии чаще других микроорганизмов встречаются в производственных дрожжах. Они принадлежат к трем родам: Streptococcus, Lactobacillus, Leuconostoc. Стрептококки и лейконостоки имеют шаровидную форму клеток. Стрептококки располагаются друг относительно друга попарно, короткими и длинными цепочками, а лейконостоки в основном попарно. Отличием этих двух родов друг от друга является то, что лейконостоки в отличие от стрептококков образуют слизистые капсулы. Лактобациллы являются палочковидными бактериями, которые в зависимости от вида могут располагаться поодиночке или короткими цепочками. Общими признаками этих бактерий являются грамположительная окраска, отсутствие спорообразования, каталазу они не образуют, не восстанавливают нитраты в нитриты, являются факультативными анаэробами. Молочнокислые стрептококки хорошо развиваются в средах, содержащих 3…6 % спирта, а палочковидные формы молочнокислых бактерий не теряют своей активности даже при 10…12 % спирта.
Уксуснокислые бактерии относятся к двум родам Acetobacter и Gluconobacter. В производстве пива чаще всего встречаются бактерии вида A. аceti. Для этих бактерий характерна чрезвычайная изменчивость формы клеток – от эллиптических до палочковидных, прямых или слегка изогнутых. Грамотрицательные, спор не образуют, некоторые виды имеют слизистую капсулу. При росте в жидкой среде образуют пленки беловатого или сероватого цвета. Реакция на каталазу положительная. Аэробы. Оптимальное значение рН 5,4-6,3, но могут расти и при рН 4,0-4,5. Эти бактерии устойчивы к антисептическим веществам хмеля, высокой кислотности, толерантны к спирту. Некоторые виды выделяют соединения, токсичные для дрожжей.
В пивоваренном производстве в засевных производственных дрожжах очень часто встречаются пивные сарцины (род Pediococcus). Сферические клетки (кокки) в парах, чаще в тетрадах или пакетах. Бесспоровые, грамположительны. Факультативные анаэробы. Каталазоотрицательные. Мезофилы. Оптимальное значение рН 4,5-5,0. Могут развиваться при содержании спирта до 8%. Лучше всего растут в присутствии дрожжей. Пивные сарцины вызывают сильное помутнение пива, сначала опалисцирующее, а затем с появлением мелкозернистого осадка. Иногда происходит увеличение вязкости пива и даже его ослизнение. Вследствие образования диацетила эти бактерии придают пиву характерный прогорклый маслянистый вкус и медовый аромат. Диацетил также отрицательно влияет на рост и размножение производственных дрожжей, ускоряет их оседание и отмирание. Развитие педиококков стимулирует образование продуктов распада белков, а также тиамина и рибофлавина, синтезируемых дрожжами.
Дикие дрожжи инфицирующие производственные дрожжи принято подразделять на две группы:
Дикие дрожжи, принадлежащие к роду Saccharomyces;
Дикие дрожжи, не принадлежащие к роду Saccharomyces.
При попадании в сусло на стадии брожения дикие дрожжи не могут интенсивно развиваться, так как их рост подавляется культурными дрожжами, количество которых по сравнению с содержанием инфицирующих пиво диких дрожжей значительно больше.
Дикие дрожжи, принадлежащие к роду Saccharomyces
В чаще всего встречаются следующие разновидности диких дрожжей-сахаромицетов: S. diastaticus, S. pastorianum, S. bayanus, S. ellipsoideus. В настоящее время все эти дрожжи принято относить к одному виду Saccharomyces cerevisiae, так как с точки зрения систематики различия в их признаках не являются существенными для разграничения видов. Клетки этих дрожжей имеют овальную или эллиптическую форму. Размножаются в основном почкованием, но могут и спорообразованием. Факультативные анаэробы. Активно сбраживают сахара. Оптимальная температура развития 27-35 0С, рН – от 3,5 до 5,0.
Дикие дрожжи, не относящиеся к роду Saccharomyces
Из производственных дрожжей выделены следующие дрожжи этой группы: дрожжи родов Candida, Torulopsis, Pichia, Hansenula, Brettanomyces, Rhodotorula и др.
Дрожжи рода Candida имеют круглые, овальные или яйцевидные, а иногда удлиненные или неправильные формы клеток. Морфология клеток непостоянна и существенно меняется в зависимости от условий культивирования и питательной среды. Спор не образуют. На жидких средах развиваются преимущественно на поверхности в виде белой или сероватой пленки. Некоторые виды являются факультативными анаэробами, а другие – аэробами. Размножению большинства видов способствует присутствие в среде кислорода. Некоторые дрожжи этого вида продуцируют специфический белок, губительно воздействующий на культурные дрожжи (дрожжи-убийцы).
Дрожжи родов Pichia и Hansenula имеют клетки различной формы – от круглых и овальных до сильно вытянутых, иногда изогнутых. Многие виды образуют псевдомицелий. Образуют споры. Большинство видов – аэробы, некоторые виды относятся к факультативным анаэробам. Размножению способствует присутствие кислорода.
Дрожжи рода Rhodotorula обычно круглой, овальной, яйцевидной или удлиненной формы Спор не образуют.
Дрожжи рода Torulopsis (пивная торула) имеют круглую или овальную форму. Спор не образуют, плохо сбраживают сахара. Основным источником попадания этих микроорганизмов в производство является воздух.
Дрожжи рода Brettanomyces имеют клетки эллиптические, а также цилиндрические, удлиненно-продолговатые, нередко стрелозаостренные с одного конца. Образуют псевдомицелий. Спор не образуют. Являются факультативными анаэробами. Плохо сбраживают сахара. На жидких средах образуют хлопьевидный или вязкий осадок, могут образовывать тонкую пленку. Многие виды устойчивы к высоким концентрациям спирта.
Помимо вышеперечисленных групп микроорганизмов, инфицирующих производственные дрожжи, в них могут присутствовать гнилостные бактерии. Это спорообразующие грамположительные бациллы и клостридии и грамотрицательные не образующие спор палочковидные бактерии. Гнилостные бактерии вызывают распад белковых веществ. В аэробных условиях они осуществляют полную минерализацию белка, вплоть до диоксида углерода, аммиака, сероводорода, воды и минеральных солей. В анаэробных условиях гнилостные бактерии образуют различные органические дурнопахнущие и ядовитые вещества. Особую опасность представляют маслянокислые бактерии (Clostridium butyricum, Clostridium pasterianum, Clostridium saccharobutyricum и др.) и нитритобразующие бактерии (например, Bacillus subtilis, Bacillus mesentericus). Маслянокислые бактерии образуют масляную кислоту, а нитритобразующие бактерии превращают нитраты в нитриты. Эти соединения даже в очень малых концентрациях (0,0005 %) подавляют развитие культурных дрожжей.
Биологическая чистота является одним из самых важных показателей качества производственных дрожжей. Особое значение этот показатель имеет в пивоваренном производстве. Это связано с тем, что в пивоварении засевные производственные дрожжи используются в нескольких производственных циклах (до 10..12 генераций) и поэтому являются основным источником попадания в производство микроорганизмов-вредителей, вызывающих прокисание, помутнение, образование осадка в пиве и придающих продукту неприятные вкус и аромат. Биологическая чистота пивных дрожжей считается удовлетворительной, если в них содержится не более 1 % бактерий и не более 0,5 % диких дрожжей.
studfiles.net
Определение β-каротина в нативной биомассе дрожжей Rhodotorula glutinis spp.
В настоящее время известно 300 каротиноидов, из них досконально изучено около 100. Биологически активны не менее 10 каротиноидов, активность которых колеблется в широких пределах [8; 9; 17; 25: 29; 30; 34; 35; 36].
В организме животных каротин превращается в витамин А в тонком отделе кишечника [15; 16; 22]. Эффективность усвоения каротиноидов зависит от физиологического статуса организма, содержания в рационах протеинов и липидов, состояния слизистой оболочки кишечника [1; 3; 5; 6; 7; 12; 13; 14; 19; 31; 32; 33; 37; 38].
Каротин играет важную роль в формировании эпителиальных тканей, снижает проницаемость слизистой пищеварительного тракта для токсических веществ и тем самым повышает резистентность организма новорожденных животных к алиментарным заболеваниям [2; 10; 11; 20; 21; 28]. Дефицит каротина в рационах отрицательно влияет на функцию размножения сельскохозяйственных животных [4; 18; 23; 24; 26; 27; 39; 40; 41].
Целью работы явилась апробация возможности оперативного определения содержания β-каротина в биомассе дрожжей Rhodotorula glutinis, после окончания культивации.
Материал и методы. В качестве объекта исследования нами выбраны дрожжи Rhodotorula glutinis, способные синтезировать β-каротин, которые выращивали на жидкой глюкозо-пептонной среде. Биомассу промывали дистиллированной водой, излишнюю влагу удаляли фильтрованием, параллельно определяли влажность. Клетки высушивали и разрушали путем растирания массы клеток с обезвоженным сульфатом натрия. Навеску подвергали многократной экстракции гексаном, ацетоном и петролейным эфиром конец которой определяли по неизменности оптической плотности экстрагента. Экстракты (5 мл) переносили на хроматографическую колонку заполненную оксидом алюминия. Каротин элюировали соответствующим растворителем, окончание хроматографии определяли по исчезновению окраски вытекающего из колонки элюата, объем которого измеряли и количественно переносили в мерную колбу на 25 мл, доводили объем до метки и фотометрировали при длине волны 450 нм.
Результаты и их обсуждение. Установлено, что для наиболее быстрой экстракции подходит ацетон (уже после второй его смены раствор оптически на уровне холостой пробы) в отличие от гексана и петролейного эфира смен которых было три.
Были получены объединенные экстракты, сканирование спектров которых мы и проводили, с предварительной регистрацией оптической плотности.
Оптическая плотность полученных экстрактов при аналитической длине волны 450 нм составила для ацетона - 0,105, гексана - 0,086 и петролейного эфира - 0,107.
На рисунке 1 представлены результаты количественного определения содержания каротина в экстрактах после предварительной хроматографии.
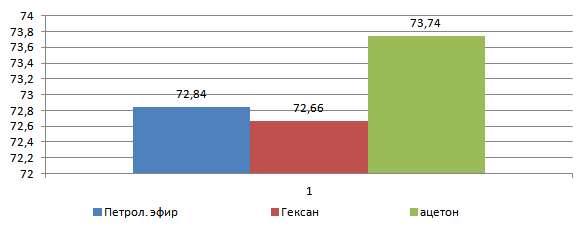
Рис. 1. Содержание β-каротина в экстрактах после хроматографического, мг %
Из графика видно, что самая высокая концентрация β-каротина наблюдается в вытяжке ацетоном, самая низкая гексаном, на основании этого можно сделать заключение, что ацетон наиболее подходящий растворитель для быстрой и полной экстракции β-каротина.
Вывод. Нами апробирована возможность быстрого, дешевого и относительно точного определения каротина в живой биомассе каротинсинтезирующих дрожжей.
Литература:
1. Антибактериальная активность микроводоросли / Ю. А. Лысенко, Н. Л. Мачнева, В. В. Борисенко, В. И. Николаенко // Молодой ученый. - 2015. - № 5-1 (85). - С. 17-20.
2. Биологическая оценка экологически безопасных растительных кормовых добавок для перепелов / И. А. Петенко, О. В. Кощаева, Д. В. Гавриленко, И. Н. Хмара // Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета. - 2014. - № 104. - С. 1540-1561.
3. Ветеринарно-санитарные аспекты выращивания кроликов при применении абсорбентно-пробиотического препарата «Органик СБА» / А. И. Петенко, И. С. Жолобова, А. И. Ющенко, Е. В. Якубенко, А. Н. Гнеуш // Ветеринария Кубани. - 2014. - № 5. - С. 8-10.
4. Гавриленко Д. В. Последействие осадков сточных вод на развитие и продуктивность озимой пшеницы / Д. В. Гавриленко // Экологический вестник Северного Кавказа. - 2011. - Т. 7, № 3. - С. 81-83.
5. Гнеуш А. Н. Применение ферментной кормовой добавки «Микозим СП+» в рационе перепелов / А. Н. Гнеуш, Ю. А. Лысенко, Н. И. Петенко // Молодой ученый. - 2015. - № 3 (83). - С. 363-366.
6. Жолобова И. С. Влияние натрия гипохлорита на перепелов в период интенсивной яйцекладки / И. С. Жолобова, А. В. Лунёва, Ю. А. Лысенко // Птицеводство. - 2013. - № 7. - С. 15-20.
7. Жолобова И. С. Влияние натрия гипохлорита на перепелок-несушек в период интенсивной яйцекладки / И. С. Жолобова, А. В. Лунева, Ю. А. Лысенко // Ветеринария. - 2014. - № 3. - С. 52-55.
8. Жолобова И. С. Сохранение БАВ в сырье тыквенного происхождения / И. С. Жолобова, С. А. Волкова, Е. Е. Нестеренко // Молодой ученый. - 2015. - № 1 (81). - С. 156-158.
9. Жолобова И. С. Эффективность применения натрия гипохлорита при силосовании кукурузы / И. С. Жолобова, С. А. Волкова, Е. Е. Нестеренко // Молодой ученый. - 2015. - № 3 (83). - С. 366-369.
10. Использование отходов переработки растительного сырья для получения функциональных кормовых добавок / С. Б. Хусид, И. С. Жолобова, С. Н. Дмитриенко, Е. Е. Нестеренко // Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета. - 2014. - № 98. - С. 706-731.
11. Клинико-фармакологическая оценка эффективности комплексной терапии мастита у коров / М. Н. Лифенцова, Ю. И. Белик, В. В. Сиренко, Д. П. Винокурова, А. С. Скрипникова // Молодой ученый. - 2015. - № 7. - С. 1035-1037.
12. Кощаев А. Г. Изучение хронической токсичности пробиотическойкормовой добавки трилактосорб для использованияв мясном перепеловодстве / А. Г. Кощаев, Ю. А. Лысенко, Е. И. Мигина // Труды Кубанского государственного аграрного университета. - 2014. - № 48. - С. 133-138.
13. Кузьминова Е. В. Нормализация функции печени у крупного рогатого скота / Е. В. Кузьминова, И. С. Жолобова, А. Г. Зафириди // Ветеринарная патология. - 2006. - № 2. - С. 140-142.
14. Лечение и профилактика бесплодия у коров и телок в мясном скотоводстве / Ю. И. Белик, М. Н. Лифенцова, В. В. Сиренко, Д. П. Винокурова, А. С. Скрипникова // Молодой ученый. - 2015. - № 7. - С. 1027-1029.
15. Лосаберидзе А. Е. Экономическая эффективность противооспенной и противомикоплазмозной иммунизации кур вакциной Vectormune ® FP MG в условиях ООО Витязевская птицефабрика / А. Е. Лосаберидзе, А. А. Лысенко, Ю. Ю. Пономаренко // Ветеринария Кубани. - 2013. - № 6. - С. 27-28.
16. Лысенко А. А. Ассоциативные заболевания прудовых рыб при интенсивном рыборазведении / А. А. Лысенко // Ветеринария. - 2003. - № 12. - С. 32.
17. Лысенко А. А. Миксоболез пестрых толстолобиков / А. А. Лысенко, Г. И. Сапожников // Ветеринария. - 2004. - № 1. - С. 17-19.
18. Лысенко А. А. Паразитофауна прудовых рыб рыбоводного хозяйства на теплых водах ТЭЦ / А. А. Лысенко, И. И. Федорова // Труды Кубанского государственного аграрного университета. - 2001. - С. 42.
19. Лысенко А. А. Эпизоотические особенности Aphtae epizooticae КРС / А. А. Лысенко, Ю. А. Лысенко, А. В. Лунева // Молодой ученый. - 2015. - № 7. - С. 1037-1040.
20. Лысенко Ю. А. Разработка и использование новой пробиотической кормовой добавки на основе функциональной микрофлоры в рецептуре комбикормов для перепелов / Ю. А. Лысенко, А. А. Ширина // Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета. - 2013. - № 91. - С. 1097-1116.
21. Марков С. А. Применение электроактивированных растворов хлоридов для обеззараживания кормов / С. А. Марков, С. Б. Хусид, И. С. Жолобова // Научные труды SWorld. - 2009. - Т. 17. - № 2. - С. 40-41.
22. Мигина Е. И. Изучение токсикологического и раздражающего действия пробиотической кормовой добавки Трилактосорб для использования в перепеловодстве / Е. И. Мигина, Ю. А. Лысенко, А. Г. Кощаев // Ветеринария Кубани. - 2014. - № 4. - С. 13-16.
23. Николаенко С. Н. Каротиноидный состав плодов тыквы / С. Н. Николаенко, С. А. Волкова, В. И. Николаенко // Молодой ученый. - 2015. - № 1 (81). - С. 166-168.
24. Новые пробиотики в кормлении птицы мясного направления продуктивности / С. А. Калюжный, Е. И. Мигина, А. Г. Кощаев, Г. В. Кобыляцкая // Научное обеспечение агропромышленного комплекса, 350044, г. Краснодар, ул. Калинина, 13. - 2012. - С. 641-643.
25. Оценка качества пшеничного солода, выращенного с использованием электроактивированных водных растворов / К. П. Федоренко, Г. А. Плутахин, Н. В. Беседина, Е. С. Яворская // Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета. - 2014. - № 100. - С. 291-304.
26. Оценка острой токсичности и раздражающего действия пробиотической кормовой добавки «Промомикс С» / А. И. Петенко, А. А. Ширина, Ю. А. Лысенко, Е. В. Якубенко, И. А. Петенко // Ветеринария Кубани. - 2013. - № 4. - С. 12-14.
27. Петенко А. И. Изучение и подбор режима культивирования культуры Azotobacter chroococcum на ферментационном комплексе ОКА МФ - 100 / А. И. Петенко, А. Н. Гнеуш, В. И. Дмитриев // Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета. - 2013. - № 94. - С. 163-179.
28. Петенко А. И. Изучение эффективности применения ферментной кормовой добавки «Микозим СП+» в рационе перепелов / А. И. Петенко, А. Н. Гнеуш, И. С. Жолобова // Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета. - 2014. - № 104. - С. 309-318.
29. Петенко А. И. Перспективы использования пробиотиков на основе молочнокислых и пропионовокислых микроорганизмов в перепеловодстве / А. И. Петенко, Ю. А. Лысенко, И. А. Петенко // Труды Кубанского государственного аграрного университета. - 2013. - № 43. - С. 66-71.
30. Петенко А. И. Повышение биологического потенциала перепелок-несушек при использовании пробиотических кормовых добавок / А. И. Петенко, Ю. А. Лысенко // Ветеринария Кубани. - 2012. - № 5. - С. 5-7.
31. Петенко А. И. Проблемы и перспективные биотехнологические решения профилактики пирикуляриоза в рисовых севооборотах / А. И. Петенко, С. А. Волкова // Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета. - 2014. - № 101. - С. 1045-1055.
32. Петенко А. И. Физиолого-биохимические аспекты подбора сортов тыквы для использования в кормопроизводстве/ А. И. Петенко, С. Б. Хусид // Труды Кубанского государственного аграрного университета. - 2013. - № 44. - С. 117-125.
33. Плутахин Г. А. Влияние способа активации водных растворов и концентрации в них кислорода на скорость прорастания ячменя / Г. А. Плутахин, К. П. Федоренко, Я. Д. Молчанов // Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета. - 2014. - № 100. - С. 276-290.
34. Семененко М. П. Влияние функциональной кормовой добавки на рост и развитие цыплят-бройлеров / М. П. Семененко, И. С. Жолобова, Т. А. Лымарь // Труды Кубанского государственного аграрного университета. - 2013. - № 45. - С. 181-182.
35. Создание внутригенных днк-маркеров и их использование в практической селекции риса / Ж. М. Мухина, Т. М. Коломиец, С. А. Волкова, Е. В. Дубина, И. И. Супрун, С. В. Токмаков, Ю. А. Мягких // Труды Кубанского государственного аграрного университета. - 2009. - № 3. - С. 63.
36. Терапевтическая эффективность применения полисептоловой мази при гиперкератозе сосков вымени у коров / В. В. Сиренко, М. Н. Лифенцова, Ю. И. Белик, Д. П. Винокурова, А. С. Скрипникова // Молодой ученый. - 2015. - № 7. - С. 1042-1045.
37. Федоренко К. П. Органолептическая оценка качества солода, полученного с применением электроактивированных водных растворов / К. П. Федоренко, Г. А. Плутахин // Молодой ученый. - 2015. - № 3 (83). - С. 374-377.
38. Федоренко Л. Н. Полимеразная цепная реакция в видоспецифической диагностике нозематоза пчел в Краснодарском крае / Л. Н. Федоренко, А. А. Лысенко, Н. В. Ковалюк // Труды Кубанского государственного аграрного университета. - 2012. - № 6. - С. 85.
39. Хусид С. Б. Биохимические аспекты консервирования витаминного растительного сырья минеральными и биологическими консервантами / С. Б. Хусид, А. И. Петенко, И. С. Жолобова // Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета. - 2014. - № 96. - С. 129-138.
40. Хусид С. Б. Подсолнечная лузга как источник получения функциональных кормовых добавок / С. Б. Хусид, А. Н. Гнеуш, Е. Е. Нестеренко // Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета. - 2015. - № 107. - С. 142-155.
41. Хусид С. Б. Разработка кормовой добавки на основе бентонита и отходов переработки риса // С. Б. Хусид, С. А. Волкова, Я. П. Донсков // Молодой ученый. - 2015. - № 1 (81). - С. 135-138.
moluch.ru
Штамм дрожжей rhodotorula glutinis - продуцент каротиноидов
Использование: микробиологическая промышленность, получение каротиноидов. Сущность изобретения: штамм дрожжей Rhodotorula glutinis выделен из почвы. Депонирован во Всероссийской коллекции промышленных микроорганизмов под номером ВКПМ V-2210. При культивировании штамма на питательной среде, включающей источники углерода, азота и минеральные соли, в глубинных условиях получают биомассу, содержащую 1450-1500 мкг/г каротиноидов.ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУ
Изобретение относится к микробиологической промышленности и касается нового штамма дрожжей, используемого для получения каротиноидов, применяемых в животноводстве, пищевой промышленности и медицине. Известны различные продуценты каротиноидов: дрожжи, грибы, бактерии и микроводоросли. Описанные микроорганизмы отличаются как по уровню накопления каротиноидов и составу пигментного комплекса, так и по условиям культивирования и по видам используемого сырья. Известен штамм дрожжей Sporolobomyces pararosens T, растущий на среде гидролизат верхового торфа. На 5 сут культивирования штамм накапливает до 3200 мкг/л каротиноидов (авт. св. СССР N 391174, опубл. 1973). Недостатком данного штамма является невысокий уровень накопления каротиноидов и большая продолжительность процесса культивирования. Известен штамм дрожжей Rhodotorula glutinis Б-71, способный расти на молочной сыворотке (авт. св. СССР N 451743, опубл. 1975). Штамм устойчив к низким значениям pH и характеризуется полнотой усвоения лактозы. Однако данный штамм не обеспечивает высокого выхода каротиноидов. Наиболее близким к изобретению по технической сущности и достигаемому эффекту является штамм дрожжей Rhodotorula glutinis 214 (авт. св. СССР N 531844, опубл. 1976). Штамм дрожжей выращивают на минеральной среде с использованием в качестве источника углерода УГВ нефти 1-1,5 об.%, углеводы 2-4%, или этанол 1 об.% . При этом дрожжи накапливают до 819 мкг/г каротиноидов на среде с УГВ нефти и до 977 мкг/г каротиноидов на углеводной среде. Недостатком данного штамма является невысокий уровень накопления каротиноидов. Задача, стоящая перед авторами изобретения, заключалась в получении нового штамма дрожжей, способного накапливать значительные количества каротиноидов на различных источниках углерода. Технический результат изобретения заключается в получении нового штамма дрожжей Rhodotorula glutinis ВКПМ V-2210 с более высокой активностью каротинообразования. Штамм выделен из почвы методом накопительных культур на минеральной среде с добавлением в качестве источника углерода этанола и глюкозы и последующим рассевом на агаризованной среде сусло. Отбор штамма проводили по активности каротинообразования. Минеральная среда имела следующий состав: (Nh5)h3PO4-10 г/л, K2HPO4 10 г/л, MgSO4 0,7 г/л. Концентрация этанола в среде 0,4 об.%, глюкозы 0,5%. Хранят штамм на солодовом сусле-агаре при комнатной температуре при периодических пересевах (2-3 раза в год). Штамм хранят также на солодовом сусле-агаре под слоем вазелинового масла. Пересев осуществляют один раз в 2-3 года. Культурально-морфологические признаки. На мальтэкстракте 3-х дневная культура при 22oC имеет слегка овальные клетки размером 2,3-5,0 x 4,0-10,0 мкм. В жидкой культуре образуется тонкая пленка и небольшой осадок. На агаризованной среде мальтэкстракт клетки морфологически сходны с жидкой культурой. Колонии окрашиваются в ярко-розовый цвет, гладкие, блестящие с ровным краем. При выдерживании на агаризованной среде в течение месяца цвет колоний усиливается. После 7-10 дней образуется не ярко выраженный псевдомицелий. На кукурузном агаре образуется слабо развитый псевдомицелий. Старая культура может образовывать истинный мицелий с темной пигментацией. Физиолого-биохимические признаки. Брожение отсутствует. Культура ассимилирует галактозу, сахарозу, мальтозу, целлобиозу, трегалозу, рафинозу, D-ксилозу, L-арабинозу, рибитол, D-манитол, янтарную кислоту, лимонную кислоту. Не ассимилирует лактозу, растворимый крахмал, L-рамнозу, эритритол, инозитол. Утилизирует аммонийный и нитратный азот. Культура не нуждается в витаминах. На среде с 50% глюкозы не растет. Крахмал не накапливает. Мочевину разлагает. Растет при температуре 37oC. Оптимальная температура роста 30oC. Оптимум pH 5,0-5,5. Аэроб. Штамм непатогенен. Биотехнологическая характеристика. Штамм накапливает до 1500 мкг/г каротиноидов, при этом содержание - каротина составляет 50%. Состав засевной среды для качалочных колб: (Nh5)h3PO4 10 г/л, K2HPO4 10 г/л, MgSO4 0,7 г/л, FeSO4·7h3O 12,5 мг/л, ZnSO4·7h3O 12,5 мг/л, MnSO4·7h3O 12,5 мг/л, NaCl 6,3 мг/л. Штамм депонирован в коллекции Всероссийского музея промышленных микроорганизмов института ГосНИИгенетика, регистрационный номер ВКПМ V-2210. Пример 1. Штамм дрожжей выращивали в ферментере Yp 1 л на питательной среде вышеописанного состава. Процесс вели при температуре 30oC, pH 5,5. Титрование осуществляли 6% раствором аммиака. В качестве источника углерода использовали этиловый спирт. Время выращивания 72 ч. Концентрацию спирта в среде поддерживали 0,4 об.%. Содержание каротиноидов в биомассе составило 1500 мкг/г. Пример 2. Штамм дрожжей выращивали в ферментере Yp 1 л на питательной среде вышеописанного состава. В качестве источника углерода использовали ферментолизат ржаной муки следующего состава: содержание редуцирующих веществ 67 г/л, содержание сухих веществ 9,0%. Количество ферментолизата ржаной муки в среде 75 мл (из расчета, чтобы РВ не превышало 0,5%). Время выращивания 72 ч. Содержание каротиноидов в биомассе составило 1489 мкг/г. Пример 3. Штамм дрожжей выращивали в ферментере Yp 1 л на питательной среде вышеописанного состава. В качестве источника углерода использовали мелассу (содержание сахарозы в мелассе 43%, сумма сбраживаемых сахаров 44%, pH 6,5 ). Количество мелассы, подаваемой в ферментер составило 6,5 мл (из расчета, чтобы концентрация сахарозы в среде не превышала 0,3%). Время выращивания 72 ч. Содержание каротиноидов в биомассе составило 1450 мкг/г. Таким образом, предлагаемый штамм дрожжей Rhodotorula glutinis ВКПМ V-2210 способен накапливать значительные количества каротиноидов на различных источниках углерода.ФОРМУЛА ИЗОБРЕТЕНИЯ
Штамм дрожжей Rhodotorula glutinis ВКПМ У-2210 продуцент каротиноидов.bankpatentov.ru
 |  |  |  |  |  |  |  |  |  |  |  |  |  |  |
 Пример видео 3 Пример видео 3 |  Пример видео 2 Пример видео 2 |  Пример видео 6 Пример видео 6 |  Пример видео 1 Пример видео 1 |  Пример видео 5 Пример видео 5 |  Пример видео 4 Пример видео 4 |
Администрация муниципального образования «Городское поселение – г.Осташков»